题目内容
【题目】从海水中制备纯碱和金属镁的流程如下图所示:
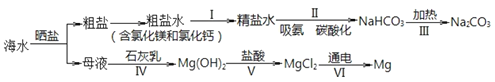
下列说法不正确的是
A.流程 I 依次向粗盐水中加入过量 Ca(OH)2 溶液、Na2CO3 溶液并过滤
B.流程 II 吸氨是使溶液呈碱性,有利于吸收二氧化碳
C.海水提镁流程中涉及到三种基本反应类型
D.流程 IV、V 是通过化学方法富集镁元素
【答案】C
【解析】
A.流程 I 是除去粗盐水中的氯化钙、氯化镁,因为除去氯化镁时需加碱,通常加入过量氢氧化钙,所以应依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液并过滤,A正确;
B.流程 II 的目的是制取NaHCO3,由于CO2在食盐水中的溶解度不大,而在碱性溶液中具有较大的溶解度,所以食盐先吸氨使溶液呈碱性,有利于吸收二氧化碳,B正确;
C.海水提镁流程中,加石灰乳和加盐酸,发生的都是复分解反应,电解氯化镁制Mg,发生的是分解反应,所以涉及到二种基本反应类型,C不正确;
D.在母液中MgCl2的浓度很小,流程 IV将氯化镁转化为Mg(OH)2沉淀,流程V将Mg(OH)2溶解重新制得MgCl2,此时MgCl2浓度大,所以通过化学方法实现镁元素的富集,D正确;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目