题目内容
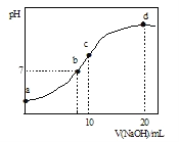
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
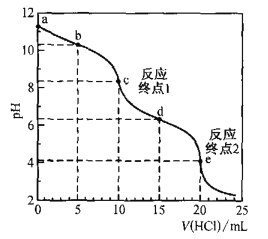
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
【答案】C
【解析】
A. 当加入10mL盐酸时,达到反应终点1,发生了反应:Na2CO3+HCl=NaHCO3+NaCl,即恰好生成了NaHCO3,n(Na2CO3)=n(HCl)=0.01L×0. 100 mol·L—1=0.001mol,所以a点溶液中c(Na2CO3)=![]() =0.020 mol·L—1,正确;
=0.020 mol·L—1,正确;
B. b点加入5mL盐酸,此时溶液中的溶质为等物质的量浓度的Na2CO3、NaHCO3和NaCl,c(Na+)最大,CO32-水解程度大于HCO3-,所以溶液中c(Na+)>c(HCO3— )>c(CO32—),正确;
C. c点溶液中有电荷守恒:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)+c(Cl—),错误;
D. e点时,溶液中溶质为NaCl和H2CO3,根据碳守恒,c(H2CO3)=![]() =
=![]() mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=
mol/L,溶液的pH为4,所以H2CO3的一级电离平衡常数Kal=![]() =
= =7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
=7×10-7,故H2CO3的一级电离平衡常数的数量级为10—7,正确;
故选C。

练习册系列答案
相关题目