题目内容
【题目】(1)利用I2O5可使CO与H2O(g)反应转化为CO2和H2,从而有效减少大气污染。该过程可通过图1所示的两步反应循环实现。
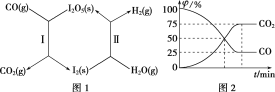
其中:反应Ⅰ为I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反应Ⅱ中,生成1 mol H2(g)时,反应热ΔH=b kJ·mol-1。
①总反应的热化学方程式为(反应热ΔH用含a、b的代数式表示)______。
②在恒温密闭容器中加入一定量的CO(g)和I2O5(s),发生反应Ⅰ并达到平衡。测得体系中各气体组分的体积分数φ随时间t的变化如图2所示。则此反应用气体分压表示的平衡常数Kp=______(已知:气体分压=气体总压×体积分数)。
(2)已知铅盐中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS难溶于水,室温下其溶度积常数为Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①将一定量的PbSO4加入足量饱和CH3COONH4溶液中,微热,并不断搅拌,因发生复分解反应,PbSO4缓慢溶解。能发生此复分解反应的原因是______。
②某溶液中主要含有S2-、SO42-等阴离子,向其中滴加Pb(NO3)2溶液,当PbSO4开始析出时,溶液中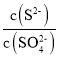 =________。
=________。
(3)钛基二氧化铅(Ti/PbO2)是重要的电极材料,工业上用电解法制作,主要流程如图:
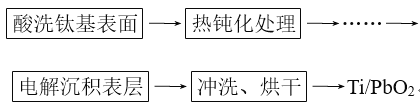
其中“电解沉积表层”是制作的关键,方法是电解可溶性铅盐溶液,使生成的PbO2沉积在阳极金属钛(Ti)上。主反应为2Pb2++2H2O=Pb+PbO2+4H+。
①必须预先将阳极金属钛进行“热钝化处理”,原因是_______。
②电解槽中,阳极主要的反应式为___;该法的缺点是阳极、阴极均会发生副反应。其中阴极上产生的气体副产物是____。
③电解法制得的PbO2晶体中含有少量的+2价铅,从而导致氧原子所在位置出现少量“空穴”(即化学式为PbOx,但x<2)。若电解时每生成1molPbOx转移1.94NA个e-(NA为阿伏加德罗常数的值),则铅元素中+2价铅所占的质量分数为____。
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=(0.2a+b)kJ·mol-1 243(或35) 生成的醋酸铅难电离 3.21×10-20 电解时,阳极材料钛可被氧化,需表面钝化防护 Pb2+-2e-+2H2O=PbO2+4H+ H2 3%(或0.03)
【解析】
(1)①根据盖斯定律确定总反应方程式;
②先计算各组分的分压,再计算平衡常数Kp;
(2)①醋酸铅是弱电解质,促进硫酸铅溶解平衡正向移动;
②由于Ksp(PbS)远小于Ksp(PbSO4),所以当PbSO4开始沉淀时,可认为S2-已沉淀完全,得到的是两种物质的饱和溶液;
(3)①钛为活性电极。
②阳极上Pb2+失电子被氧化为PbO2;阴极上除Pb2+能得电子外,溶液中的H+也会得电子发生还原反应。
③每生成1 molPbO2转移2 mol电子,若转移1.94 mol电子,则生成0.97 mol PbO2,所以1 mol PbOx中有0.03 mol Pb2+。
(1)①反应Ⅱ的热化学方程式为I2(s)+5H2O(g)=I2O5(s)+5H2(g) ΔH=5b kJ·mol-1,结合反应Ⅰ:I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1,得到总反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=(0.2a+b) kJ·mol-1。
②设气体的总压强为p,则平衡时,p(CO)=p×25%,p(CO2)=p×75%。Kp=![]() =
=![]() =35=243。
=35=243。
(2)①硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成弱电解质醋酸铅,促进硫酸铅溶解。
②由于Ksp(PbS)远小于Ksp(PbSO4),所以当PbSO4开始沉淀时,可认为S2-已沉淀完全,得到的是两种物质的饱和溶液,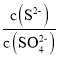 =
=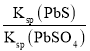 =
=![]() =3.21×10-20;
=3.21×10-20;
(3)①钛为活性电极,若不进行“热钝化处理”,阳极金属钛会放电溶解。
②阳极上Pb2+失电子被氧化为PbO2,电极反应式为Pb2+-2e-+2H2O=PbO2+4H+;阴极上除Pb2+能得电子外,溶液中的H+也会得电子放出H2。
③每生成1 molPbO2转移2 mol电子,若转移1.94 mol电子,则生成0.97 mol PbO2,所以1 mol PbOx中有0.03 mol Pb2+,其在铅元素中的质量分数为![]() =3%。
=3%。

【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
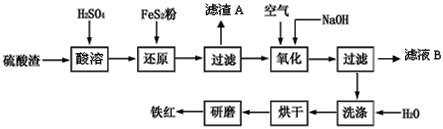
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
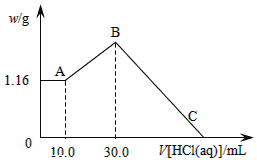
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
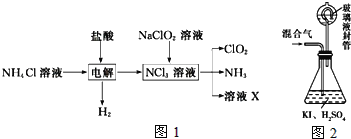
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【题目】下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
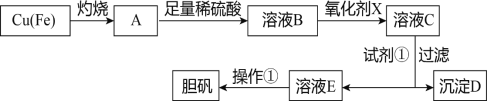
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.7 | 7.5 | 4.4 |
完全沉淀 | 3.7 | 9.7 | 6.7 |
请回答:
(1)溶液B中含有的阳离子有____________________(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__________(填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,要调整pH范围是_____________,则试剂①可以选择______________(填化学式)。
(4)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是____________________________________(用离子方程式表示)。
(5)溶液E经过操作①可得到胆矾,操作①为________________________、过滤、洗涤。
(6)已知溶液中c(Cu2+)与pH的关系为lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1mol/L,此时溶液中的Fe3+能否沉淀完全:___________(填“能”或“否”) 。