题目内容
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
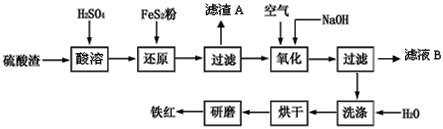
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
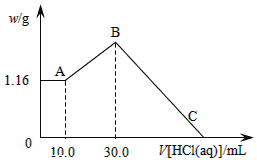
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
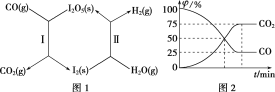
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
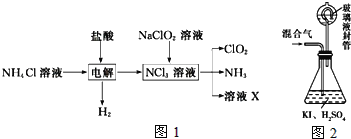
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【答案】Fe2O3+6H+=2Fe3++3H2O FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ 3.2~3.8 5.20 130.0 0.02700 d
【解析】
硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红。
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3+ +3H2O。
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,检验Fe3+被完全还原的实验操作和现象为取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3 +已被完全还原,故答案为:FeS2+14Fe3 + +8H2O=15Fe2++2SO42-+16H+。
(3)溶液pH>3.2时Fe3+沉淀完全,溶液pH=3.8时Al3+开始沉淀,故溶液的pH的范围是3.2~3.8,根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;故答案为:3.2~3.8。
(二)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100mL,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30mL+100mL=130.0mL,故答案为:130.0mL。
(三)①含有Na2S2O3物质的量为0.02L×0.1mol/L=0.002mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,所以m(ClO2)=0.0004 mol×67.5g/mol=0.02700g,故答案为:0.02700。
②若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,故答案为:d。

【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
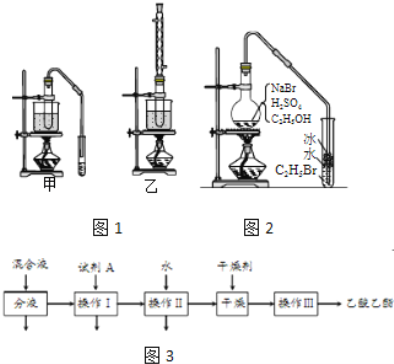
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
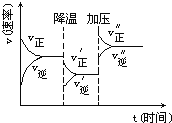
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。