题目内容
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
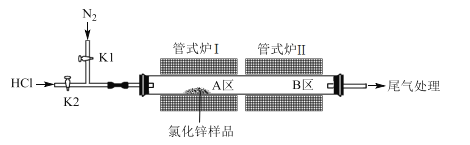
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。

【答案】![]() As的4p能级是半充满状态,比较稳定 分子 NO2- 正四面体形 sp3杂化 4
As的4p能级是半充满状态,比较稳定 分子 NO2- 正四面体形 sp3杂化 4 ![]() ×107
×107
【解析】
(1)硒为34号元素,有6个价电子, 所以基态Se原子价电子的轨道表示式为![]() 因此,本题正确答案是:
因此,本题正确答案是: ![]() ;
;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素的P轨道上是半充满状态,比较稳定,所以第一电离能大于相邻元素, As为第ⅤA族元素,Se为第IVA族元素,所以As的第一电离能比Se大,答案:As的4p能级是半充满状态,比较稳定;
(3) SeO2常温下白色晶体,熔、沸点低,所以属于分子晶体;二氧化硒分子中价层电子对=2+1/2(6-2×2)=3,Se原子的杂化类型为SP2,且含有一个孤电子对, 属于V形;与NO2-的价电子和原子数都相等,属于SeO2的等电子体,所以NO2-与SeO2互为等电子体;因此,本题答案是:分子晶体; NO2-;
(4) SeO42-的中心原子的价层电子对数为(6+2)/2=4,所以Se杂化方式为sp3杂化,离子中没有孤电子对,所以SeO42-的立体构型是正四面体形。
因此,本题答案是: sp3;正四面体形。
(5)根据硒化锌晶胞结构图可以知道,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×1/8+6×1/2=4,含有锌原子数为4,根据ρ=m/V=4M/NAV,所以V=4M/ρNA,则晶胞的边长为![]() cm=
cm=![]() ×1010pm,
×1010pm,
因此,本题正确答案是:4; ![]() ×1010pm
×1010pm

【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D
【题目】如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A. AB. BC. CD. D