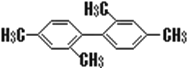
题目内容
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图、下列说法不正确的是
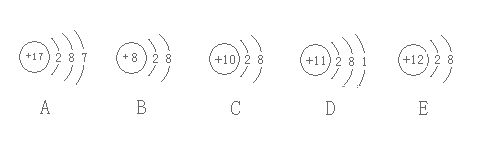
A.B、C、E三种微粒均为稳定结构
B.A与D、B与E均可以形成微粒比为1:1的化合物
C.在0.5mol/LDAB溶液中滴加适量稀盐酸不能增强溶液的漂白能力
D.A与B可以形成A2B7的化合物
【答案】C
【解析】
质子数与核外电子数相等为原子,金属性越强的元素越易失去电子,非金属性越强的元素越易得到电子;周期表中上周期右边的元素形成的离子与下周期左边的元素形成的离子具有相同的核外电子排布。
根据结构示意图可知,A为Cl、B为O2-、C为Ne、D为Na、E为Mg2+;
A.B为O2-、C为Ne、E为Mg2+,三种微粒的最外层均为8e-稳定结构,故A正确;
B.Cl与Na组成NaCl、O2-与Mg2+组成MgO,则均形成微粒比为1:1的化合物,故B正确;
C.在0.5mol/LNaClO溶液中滴加适量稀盐酸,可提高HClO的浓度,增强溶液的漂白能力,故C错误;
D.A为Cl元素,其最高价为+7,B为O元素,则可以形成Cl2O7的化合物,故D正确;
故答案为C。

练习册系列答案
相关题目