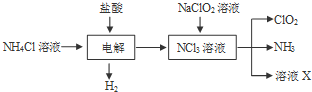
题目内容
6.下列溶液中,氯离子浓度最大的是( )| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
分析 根据物质的化学式及物质的物质的量浓度来计算氯离子的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.
解答 解:A.c(Cl-)=c(NaCl)=1mol•L-1,故A错误;
B.c(Cl-)=2c(MgCl2)=2mol•L-1,故B错误;
C.c(Cl-)=c(HCl)=1mol•L-1,故C错误;
D.c(Cl-)=3c(AlCl3)=3mol•L-1,故D正确.
故选D.
点评 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,难度不大,所含微粒的物质的量浓度与所取溶液的体积大小无关.

练习册系列答案
相关题目
16.下列物质属于共价化合物的是( )
| A. | CaO | B. | CO2 | C. | K2O | D. | NaCl |
14.一个集气瓶的质量为20.0g,在相同状况下,装满O2时质量为21.0g,装满A气体时为22.0g,则A气体的摩尔质量为( )
| A. | 16g/mol | B. | 32g/mol | C. | 64g/mol | D. | 128g/mol |
1.将2.48g Na和Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,将混合气体用电火花引燃恰好完全反应,则Na和Na2O2的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:1 |
11.如果Mg2+、M、Fe3+、Cl-四种离子以物质的量之比1:2:2:4共存于同一溶液中,则M可能是( )
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | OH- | D. | NO${\;}_{3}^{-}$ |
18.下列各组离子在水溶液里能大量共存.但用盐酸酸化后却不能大量共存的离子组是( )
| A. | Mg+、Al3+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、SO42- | ||
| C. | Ba2+、Na+、K+、NO3- | D. | K+、Ca2+、CO32-、OH- |
15.物质的量均为0.4mol的钠、镁、铝,分别与50mL 2.0mol/L盐酸反应,则生成的H2在同温同压下的体积比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 4:1:1 | D. | 6:3:2 |
 新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.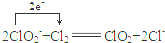 .
.