题目内容
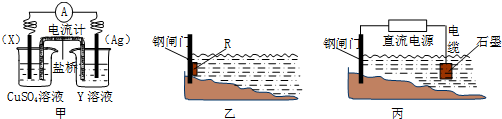
14.用二氧化氯(ClO2)新型净水剂替代传统的净水剂Cl2,对淡水进行消毒是城市饮用水处理的新技术.(1)已知ClO2在水处理过程中被还原为Cl-.若以单位质量的氧化剂所得到的电子数来表示消毒效率,则ClO2、Cl2两种消毒剂的消毒效率由小到大的顺序是Cl2<ClO2.(填化学式)
(2)ClO2的制备方法:
①工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并标出电子转移的方向和数目
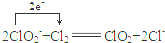 .
.②纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物Y与NaClO3反应生成ClO2.完成反应的化学方程式:
1 C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4,
假设该反应在标准状况下生成1.12L气体,则转移的电子数为0.04NA.
③实验室通常以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
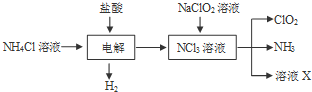
推测溶液X为NaCl和NaOH溶液.
(3)ClO2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收ClO2,以减少环境污染.
若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为80.0g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有500mL容量瓶、烧杯.配制该溶液时,下列操作会使溶液浓度偏高的是CD.(填字母)
A.称量固体时动作缓慢
B.容量瓶未干燥立即用来配制溶液
C.NaOH固体溶解后立刻转移
D.在容量瓶中定容时俯视容量瓶刻度线
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
分析 (1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{71}$×2×1;
(2)①Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子;
②纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;由配平的化学方程式可知生成24molClO2和6mol CO2气体转移24mol的电子;
③由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,反应方程式为NH4Cl+2HCl═3H2↑+NCl3.NaClO2和NCl3溶液混合反应生成NH3、CO2和X,结合元素化合价变化和电子守恒、原子守恒配平书写化学方程式确定X;
(3)依据m=nM计算需要的氢氧化钠溶质的质量,配制溶液需要天平称量固体质量,精确到0.1g,若实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还含有烧杯和500ml容量瓶,
A.称量固体时动作缓慢,可能导致氢氧化钠吸收水蒸气和空气中的二氧化碳,导致溶质减小;
B.容量瓶未干燥立即用来配制溶液对配制溶液的结果无影响;
C.NaOH固体溶解后溶液温度升高,立刻转移溶液温度升高,常温下溶液浓度增大;
D.在容量瓶中定容时俯视容量瓶刻度线,液面倍提高,定容未达到刻度;
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液浓度减小;
解答 解:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{71}$×2×1,所以由大到小的顺序为ClO2>Cl2,
故答案为:Cl2<ClO2;
(2)①Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为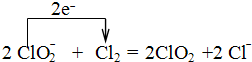 ,
,
故答案为: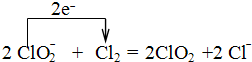 ;
;
②纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
30mol的气体~24mole-
30×22.4L 24mol
1.12L 0.16mol
所以转移电子数为0.04NA,
故答案为:1;C6H12O6;24;6;12;Na2SO4,0.04NA;
③由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,反应方程式为NH4Cl+2HCl═3H2↑+NCl3.NaClO2和NCl3溶液混合反应生成NH3、CO2和X,N元素化合价+6价变化为-3价,氯元素化合价降低1,电子转移总数为6,化学方程式为:6ClO2-+NCl3+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,所以X为NaCl和NaOH溶液,
故答案为:NaCl和NaOH溶液;
(3)实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,配制溶液需要天平称量固体质量,精确到0.1g,依据m=nM计算需要的氢氧化钠溶质的质量=0.5L×4mol/L×40g/mol=80.0g,若实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还含有烧杯和500ml容量瓶,
A.称量固体时动作缓慢,可能导致氢氧化钠吸收水蒸气和空气中的二氧化碳,导致溶质减小,测定结果偏低,故A错误;
B.最后配制溶液需要加入水定容,容量瓶未干燥立即用来配制溶液对配制溶液的结果无影响,故B错误;
C.NaOH固体溶解后溶液温度升高,立刻转移溶液温度升高,常温下液面未达到刻度,溶液浓度增大,故C正确;
D.在容量瓶中定容时俯视容量瓶刻度线,液面倍提高,定容未达到刻度,溶液浓度增大,故D正确;
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,水加入超出刻度线,溶液浓度减小,故E错误;
故选CD.
故答案为:80.0,500mL容量瓶、烧杯,CD;
点评 本题考查了氧化还原反应电子转移,电子守恒计算分析,化学方程式书写,溶液配制方法和过程分析应用,掌握基础是解题关键,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
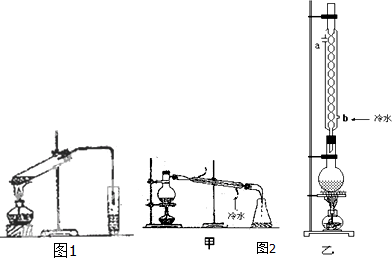
实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(2)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(3)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗.
(4)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?答:乙,反应物能冷凝回流.
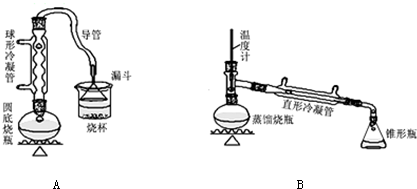
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答:不合理,产物1-溴丁烷也含有-CH2CH2CH2CH3.
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
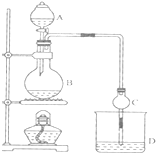 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
| A. | K22=$\frac{1}{{k}_{1}}$ | B. | K1=K2 | C. | K12=K2 | D. | 无法确定 |