题目内容
17. 新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.(1)写出温度低于570℃时反应的化学方程式Fe+H2O(g)$\frac{\underline{\;低于570°C\;}}{\;}$ FeO+H2.
(2)中学教材中用如图所示实验装置,完成铁粉与水蒸气反应的演示实验.实验中使用肥皂液的作用是检验反应中生成的H2.
(3)乙同学为了探究实验后的固体产物是否存在Fe3O4(假定铁全部反应完全)设计下列实验方案:
①取固体样品m1g,溶于足量的稀盐酸;
②向①反应后的溶液中加入足量H2O2得溶液X再加氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2g.
溶液X中发生氧化还原反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;m1与m2符合$\frac{{m}_{1}}{{m}_{2}}$=0.97关系时,才能确定固体样品中一定只存在Fe3O4.
分析 (1)纳米级铁粉与水蒸气反应,温度低于570℃时,生成FeO,结合原子守恒写出化学方程式;
(2)使用肥皂液的作用是检验反应中生成的H2;
(3)取固体样品m1g,溶于足量的稀盐酸,双氧水可将二价铁离子氧化为三价铁离子,利用极限法来假设全部是FeO或Fe3O4计算m1与m2之比.
解答 解:(1)纳米级铁粉与水蒸气反应,温度低于570℃时,生成FeO,反应的化学方程式为:Fe+H2O(g)$\frac{\underline{\;低于570°C\;}}{\;}$FeO+H2,
故答案为:Fe+H2O(g)$\frac{\underline{\;低于570°C\;}}{\;}$FeO+H2;
(2)使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明“铁与水蒸气”能够进行反应,故答案为:检验反应中生成的H2;
(3)双氧水可将二价铁离子氧化为三价铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
固体样品m1克与红棕色固体m2克所含铁元素的物质的量相同,假设全部是FeO,
2FeO~Fe2O3
144g 160g
m1与m2之比=$\frac{144g}{160g}$=0.9;
假设全部是Fe3O4,
2Fe3O4~3Fe2O3
464g 480g
m1与m2之比为:$\frac{{m}_{1}}{{m}_{2}}$=$\frac{464g}{480g}$=0.97,
m1与m2之比最少应大于 0.97时,固体样品中一定存在Fe3O4,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;$\frac{{m}_{1}}{{m}_{2}}$=0.97.
点评 本题考查铁及其化合物的性质,难度较大,③中的计算是难点,学生应充分利用信息并结合极限法来综合应用解答本题.

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡胶塞 |
| A. | 锂 | B. | 硅 | C. | 镍 | D. | 二氧化硅 |
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中燃烧:H2+Cl2═2H++2Cl- | |
| C. | 小苏打治疗胃酸过多:H++HCO3-═H2O+CO2↑ | |
| D. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu═Fe2++Cu2+ |
| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
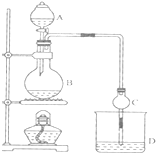 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.