题目内容
15.物质的量均为0.4mol的钠、镁、铝,分别与50mL 2.0mol/L盐酸反应,则生成的H2在同温同压下的体积比为( )| A. | 1:1:1 | B. | 1:2:3 | C. | 4:1:1 | D. | 6:3:2 |
分析 n(HCl)=2.0mol/L×0.05L=0.1mol,如果盐酸完全反应,根据转移电子守恒得消耗n(Na)=n(HCl)=0.1mol<0.4mol;消耗n(Mg)=$\frac{0.1mol}{2}$=0.05mol<0.4mol,消耗n(Al)=$\frac{0.1mol}{3}$=$\frac{1}{30}$mol<0.4mol,但钠和水反应,镁、铝和水不反应,所以镁、铝都剩余,据此分析解答.
解答 解:n(HCl)=2.0mol/L×0.05L=0.1mol,如果盐酸完全反应,根据转移电子守恒得消耗n(Na)=n(HCl)=0.1mol<0.4mol;消耗n(Mg)=$\frac{0.1mol}{2}$=0.05mol<0.4mol,消耗n(Al)=$\frac{0.1mol}{3}$=$\frac{1}{30}$mol<0.4mol,但钠和水反应,镁、铝和水不反应,所以镁、铝都剩余,钠完全反应生成氢气物质的量为0.2mol,Mg、Al反应生成氢气物质的量为0.05mol,相同条件下气体体积之比等于其物质的量之比=0.2mol:0.05mol:0.05mol=4:1:1,
故选C.
点评 本题考查化学化学方程式有关计算,为高频考点,正确判断过量计算是解本题关键,注意:钠能和水反应而镁、铝和水不反应是解本题关键,为易错点.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
6.下列溶液中,氯离子浓度最大的是( )
| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
6.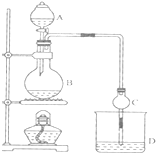 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是催化剂、吸水剂;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
10.下列应用或事实与胶体的性质没有关系的是( )
| A. | 用明矾净化饮用水 | |
| B. | 放电影时,放映室射到银幕上的光柱 | |
| C. | 氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 滚滚长江流入大海处,形成长江三角沙洲 |
20.下列说法正确的是( )
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L任何气体都含有约6.02×1023个分子 | |
| D. | 在标准状况下1mol H2O的体积约为22.4L |
7. 某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
 某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )| A. | 烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+ | |
| B. | a中的氧化铁与盐酸反应生成氯化铁 | |
| C. | b中收集到的气体是氢气 | |
| D. | 烧杯中溶液蒸发结晶得到氯化铁晶体 |
4.一定条件下,下列反应呈平衡状态时的平衡常数:K1:3H2+N2?2NH3;K2:NH3?$\frac{3}{2}$H2+$\frac{1}{2}$N2.则K1与K2的关系为( )
| A. | K22=$\frac{1}{{k}_{1}}$ | B. | K1=K2 | C. | K12=K2 | D. | 无法确定 |
5.下列关于物质的用途,叙述不正确的是( )
| A. | 过氧化钠可用作供氧剂 | B. | HF可以用于刻蚀玻璃 | ||
| C. | 镁铝合金可用作制造飞机的材料 | D. | 高纯硅用来制造光导纤维 |