题目内容
5.高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
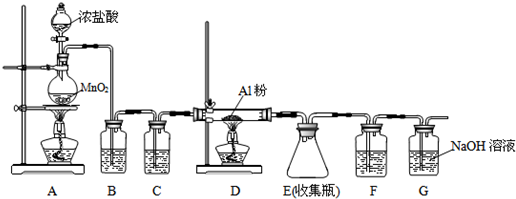
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
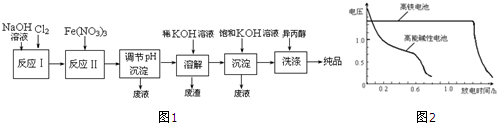
分析 反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其它杂质,得到纯产品高铁酸钾,
(1)①实验室用浓盐酸和二氧化锰在加热条件下制取氯气;
②反应I为氢氧化钠和氯气发生氧化还原反应生成NaCl、NaClO和水;
③次氯酸根离子和铁离子、氢氧根离子发生氧化还原反应生成高铁酸根离子、氯离子和水;
(2)高铁酸钾具有强氧化性,能杀菌消毒;反应生成的铁离子水解生成的氢氧化铁胶体,胶体具有吸附性,从而净化水;
(3)根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数来分析氧化剂与还原剂的物质的量之比;
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,正极上高铁离子得电子发生还原反应;阴极上氢氧化锌得电子发生还原反应;
高铁电池放电时间长,工作电压稳定.
解答 解:反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其它杂质,得到纯产品高铁酸钾,
(1)①实验室用浓盐酸和二氧化锰在加热条件下制取氯气,反应方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②反应I为氢氧化钠和氯气发生氧化还原反应生成NaCl、NaClO和水,反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
③次氯酸根离子和铁离子、氢氧根离子发生氧化还原反应生成高铁酸根离子、氯离子和水,离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
(2)高铁酸钾具有强氧化性,能杀菌消毒;反应生成的铁离子水解生成的氢氧化铁胶体,胶体具有吸附性,从而净化水,
故答案为高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水;
(3)Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,氮元素的化合价降低,铁元素的化合价升高,则KNO3为氧化剂,Fe2O3为还原剂,氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,正极上高铁离子得电子发生还原反应,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-;阴极上氢氧化锌得电子发生还原反应,电极反应式为Zn(OH)2+2e-=Zn+2OH-;
高铁电池放电时间长,工作电压稳定,
故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-;Zn(OH)2+2e-=Zn+2OH-;放电时间长,工作电压稳定.
点评 本题考查物质制备,为高频考点,涉及原电池和电解池原理、氧化还原反应、气体制备、盐类水解等知识点,明确反应原理及物质性质是解本题关键,难点是电极反应式的书写,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c (CO)=0.2mol•L-1,则H2的转化率为53.3%,此时的温度为250℃,若在此温度下测得某时刻体系内各物质的浓度如下:c (CO)=0.5mol•L-1,c (H2)=0.2mol•L-1,c (CH3OH)=0.1mol•L-1,则此时该反应向逆方向进行(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
(3)要提高CO的转化率,可以采取的措施是DF.
A.升温 B.加入催化剂 C.增加CO的浓度
D.加入H2 E.加入惰性气体 F.分离出甲醇.
| A. | 反应过程中吸收大量的热 | |
| B. | 反应前后原子个数不变 | |
| C. | 该反应属于置换反应 | |
| D. | 参加反应的乙烯和氧气的质量比为9:24 |