题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
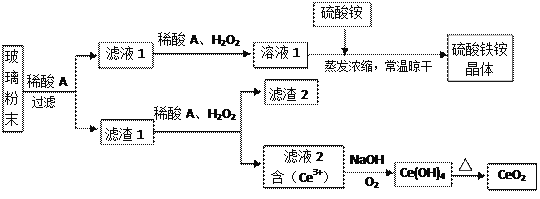
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是_________________________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为___________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式_____________________________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理。相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。
该产品中Ce(OH)4的纯度为__________________。(保留两位有效数字)
【答案】 H2SO4 使Fe2+氧化为Fe3+ 铁氰化钾溶液(或高锰酸钾溶液) Fe2+ +2FeO(OH)=Fe3O4 +2H+ 4Ce 3 ++ O2 +12OH-+2H2O ==4 Ce(OH)4↓ 降低 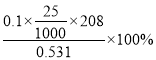 =98%(或0.98)
=98%(或0.98)
【解析】(1)根据流程中后面出现的硫酸盐,可推出稀酸A为稀硫酸,其分子式是:H2SO4;(2)根据后面所得产品为硫酸铁铵晶体,铁应该为+3价,而废玻璃粉末中含有氧化铁和氧化亚铁,滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+,以免产品不纯;(3)滤液1中含有铁离子,若要检验其中还含有Fe2+,必须利用亚铁离子具有的性质进行检验,而不能再利用氧化剂和KSCN溶液进行检验,所用试剂可以为:铁氰化钾溶液或高锰酸钾溶液;(4)根据质量守恒和电荷守恒可得:Fe2+和难溶于水的FeO(OH)反应生成Fe3O4的离子方程式为:Fe2+ +2FeO(OH)=Fe3O4 +2H+;(5)滤液2 Ce 3 +在碱性条件下与被氧气氧化生成Ce(OH)4沉淀的离子方程式为:4Ce3 ++ O2 +12OH-+2H2O =4 Ce(OH)4↓;(6)硫酸铁铵晶体用于水的净化处理是利用铁离子水解产生氢氧化铁胶体,吸附水中的悬浮物,酸性废水中氢离子抑制铁离子的水解,故在去除酸性中的悬浮物时效率降低;(7)根据电子守恒Ce从+4价变为+3价,铁由+2价变为+3价,则建立关系式:Ce(OH)4~FeSO4,设该产品中Ce(OH)4的纯度为x,则:
Ce(OH)4~FeSO4
1 1
![]() 0.1000mol/L×0.025L,
0.1000mol/L×0.025L,
解得:x=![]() =0.98=98%。
=0.98=98%。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案