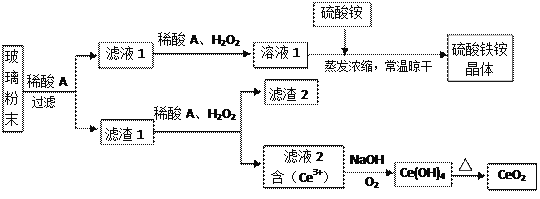
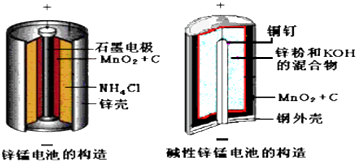
题目内容
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+ , 模拟装置如图所示.下列说法正确的是( ) 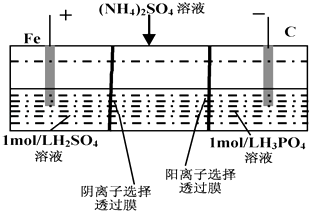
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的酸性减弱
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
【答案】C
【解析】解:A.根据图片知,Fe与电源正极相连为阳极,阳极上Fe2+失电子发生氧化反应生成Fe3+ , 电极反应式为Fe2+﹣e﹣=Fe3+ , 所以溶液由浅绿色变为棕黄色,故A错误;
B.阴极上H+放电生成H2 , 电极反应式为2H2O+4e﹣═2OH﹣+H2↑,故B错误;
C.电解时,阴极上H+放电生成H2 , 溶液中c(H+)减小,酸性减弱,故C正确;
D.电解时,溶液中NH4+向阴极室移动,H+放电生成H2 , 溶液中OH﹣和NH4+结合生成电解质NH3 . H2O,所以阴极室中溶质为NH3 . H2O和(NH4)3PO4或NH4HPO4、(NH4)2HPO4 , 故D错误;
故选:C.

练习册系列答案
相关题目
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲