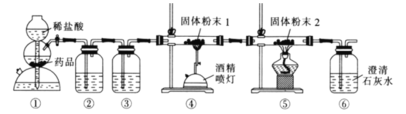
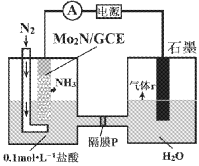
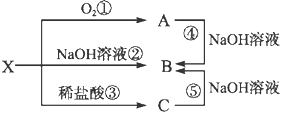
题目内容
【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。

【答案】![]()
![]()
![]()
![]() 取少量此溶液于试管中,滴加几滴酸性高锰酸钾溶液,若
取少量此溶液于试管中,滴加几滴酸性高锰酸钾溶液,若![]() 紫
紫![]() 红色褪去,则此溶液含有
红色褪去,则此溶液含有![]() 过滤、洗涤、干燥
过滤、洗涤、干燥![]() 或烘干
或烘干![]()
![]()
![]()
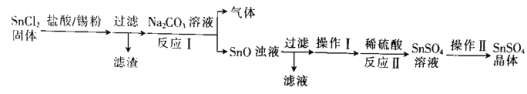
【解析】
![]() 与盐酸不反应,用盐酸酸浸时
与盐酸不反应,用盐酸酸浸时![]() 不溶解,过滤分离,滤渣A为
不溶解,过滤分离,滤渣A为![]() ,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使
,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使![]() 转化为
转化为![]() 沉淀,过滤分离,滤渣B为
沉淀,过滤分离,滤渣B为![]() 滤液中再加入ZnS,
滤液中再加入ZnS,![]() 转化为CuS沉淀,过滤除去CuS,滤液为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等。
转化为CuS沉淀,过滤除去CuS,滤液为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等。
(1)据以上分析可知,滤渣A为SiO2,滤渣B为Fe(OH)3,故答案为:, SiO2;Fe(OH)3;
(2)除锰过程中,酸性条件下,锰离子与双氧水发生氧化还原反应生成![]() 沉淀,反应离子方程式为:
沉淀,反应离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制pH使铁离子沉淀完全,而
时加入ZnO控制pH使铁离子沉淀完全,而![]() 不能沉淀,故控制反应液pH的范围为
不能沉淀,故控制反应液pH的范围为![]() ,故答案为:
,故答案为:![]() ;
;
②有![]() 具有还原性可以被酸性高锰酸钾溶液氧化,所以酸性高锰酸钾紫色褪去,故答案为:取少量此溶液于试管中,滴加几滴酸性高锰酸钾溶液,若
具有还原性可以被酸性高锰酸钾溶液氧化,所以酸性高锰酸钾紫色褪去,故答案为:取少量此溶液于试管中,滴加几滴酸性高锰酸钾溶液,若![]() 紫
紫![]() 红色褪去,则此溶液含有
红色褪去,则此溶液含有![]() ;
;
(4)沉淀后的滤液溶质是草酸锌,经过过滤、洗涤、干燥,即可制得草酸锌晶体,故答案为:过滤、洗涤、干燥![]() 或烘干
或烘干![]() ;
;
(5)草酸锌晶体中的![]() 质量分数为
质量分数为![]() ,故A点完全失去结晶水,化学式为
,故A点完全失去结晶水,化学式为![]() ,假设B点为ZnO,则残留固体占有的质量分数为
,假设B点为ZnO,则残留固体占有的质量分数为![]() ,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与
,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与![]() ;
;![]() 范围内,则发生反应的化学方程式为:
范围内,则发生反应的化学方程式为:![]()
![]() ;故答案为:
;故答案为:![]()
![]() 。
。

 亮点激活精编提优100分大试卷系列答案
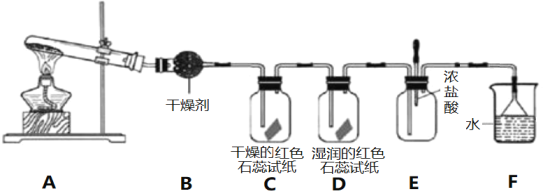
亮点激活精编提优100分大试卷系列答案【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡![]() 熔点
熔点![]() 与
与![]() 反应制备
反应制备![]() ,装置如图。
,装置如图。
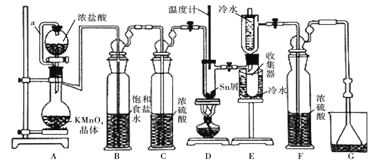
已知:![]() 、
、![]() 有关物理性质:
有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
![]() 极易水解生成
极易水解生成![]() 。回答下列问题:
。回答下列问题:
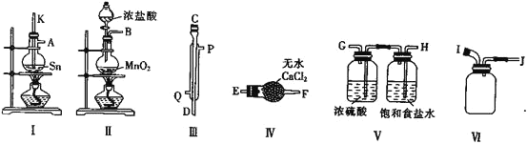
(1)导管a的作用是____________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是![]() ________;
________;![]() ______
______
(3)若上述装置中缺少装置![]() 其它均相同
其它均相同![]() ,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)![]() 和锡的反应产物有
和锡的反应产物有和
![]() ,为防止产品中带入过多的
,为防止产品中带入过多的![]() ,可采取的措施是____________________________________________。
,可采取的措施是____________________________________________。
(5)滴定分析产品中2价![]() Ⅱ
Ⅱ![]() 的含量:用分析天平称取
的含量:用分析天平称取![]() 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用
产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用![]() 的碘标准溶液滴定至终点时消耗
的碘标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() Ⅱ
Ⅱ![]() 的质量分数为___________。
的质量分数为___________。![]() 小数点后保留2位,已知
小数点后保留2位,已知![]()