题目内容
【题目】钼![]() 最重要的用途是作为铁合金的添加剂,用CO还原
最重要的用途是作为铁合金的添加剂,用CO还原![]() 制备单质Mo的装置如图所示
制备单质Mo的装置如图所示![]() 尾气处理装置已省略
尾气处理装置已省略![]() 下列说法正确的是
下列说法正确的是![]()
![]()
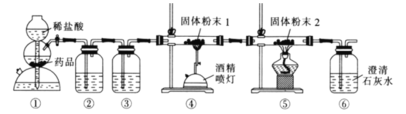
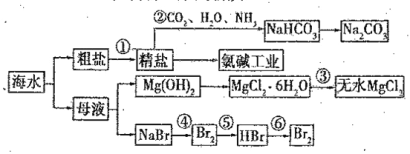
A.装置![]() 中的药品为石灰石粉末
中的药品为石灰石粉末
B.装置![]() 中盛有饱和碳酸氢钠溶液,
中盛有饱和碳酸氢钠溶液,![]() 中盛有澄清石灰水
中盛有澄清石灰水
C.在装置![]() 中生成了钼单质
中生成了钼单质
D.![]() 中溶液变浑浊,说明产生的
中溶液变浑浊,说明产生的![]() 一定是来自
一定是来自![]()
【答案】C
【解析】
![]() 由稀盐酸和石灰石制备二氧化碳,制得的二氧化碳混有HCl和水蒸气,用
由稀盐酸和石灰石制备二氧化碳,制得的二氧化碳混有HCl和水蒸气,用![]() 中饱和碳酸氢钠溶液吸收HCl,用
中饱和碳酸氢钠溶液吸收HCl,用![]() 中浓硫酸吸收水蒸气,纯净干燥的二氧化碳与C在
中浓硫酸吸收水蒸气,纯净干燥的二氧化碳与C在![]() 中高温反应生成CO,CO与
中高温反应生成CO,CO与![]() 在装置
在装置![]() 中反应制备单质Mo,
中反应制备单质Mo,![]() 检验装置
检验装置![]() 中生成的二氧化碳,据此分析作答。
中生成的二氧化碳,据此分析作答。
A.装置![]() 用于制备
用于制备![]() ,药品应为块状石灰石,否则不能控制反应随关随停,故A错误;
,药品应为块状石灰石,否则不能控制反应随关随停,故A错误;
B.装置![]() 中盛有饱和碳酸氢钠溶液,以除去
中盛有饱和碳酸氢钠溶液,以除去![]() 中的HCl气体,
中的HCl气体,![]() 中应该盛有浓硫酸,干燥二氧化碳气体,故B错误;
中应该盛有浓硫酸,干燥二氧化碳气体,故B错误;
C.在装置![]() 中用CO还原
中用CO还原![]() 生成了钼单质和二氧化碳,故C正确;
生成了钼单质和二氧化碳,故C正确;
D.![]() 中的二氧化碳可能来源于
中的二氧化碳可能来源于![]() 中未反应完的,故不能说明产生的
中未反应完的,故不能说明产生的![]() 一定是来自
一定是来自![]() ,故D错误;
,故D错误;
故选C。

【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1=-285.8 kJ/mol;
H2O(l) ΔH1=-285.8 kJ/mol;
②CO (g)+1/2O2 (g)![]() CO2 (g) ΔH2=-283kJ/mol
CO2 (g) ΔH2=-283kJ/mol
③CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
则工业制备甲醇的可逆反应热化学方程式为_______________________________;
(2)恒温恒容条件下,下列描述中能说明上述反应已达平衡状态的是__________。
A.单位时间内生成n mol CO的同时生成2n mol H2 B.ν(H2)正=2ν(CH3OH)逆
C.容器内气体的密度保持不变 D.容器中气体的压强保持不变
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,CO物质的量随时间变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
n(CO)/mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
则从反应开始到20min时,以ν(H2)=________,该温度下平衡常数K=_______。
(4)加入催化剂后在250 ℃开始反应,CO的平衡转化率与温度、压强的关系如图所示。
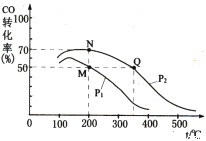
①M、N、Q三点的平衡常数KM、KN、KQ的大小关系为___________________________。
②由M点到N点改变的外界条件是_________。
A、降低温度 B、增大压强
C、改用更好的催化剂 D、通入更多的CO
(5)25℃时以稀硫酸为电解质溶液制成甲醇燃料电池,则负极的电极方程式为_________________________。
【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。