题目内容
【题目】CO+H2的混合气体又称“合成气”,在合成有机物中应用广泛。工业上常采用天然气与水蒸气或二氧化碳反应等方法来制取合成气。请回答下列问题:
(1)已知在一定条件下,0.25molCH4 与水蒸气完全反应制备“合成气”时吸收51.5kJ 的热量,请写出该反应的热化学方程式__________________________________________________。
(2)天然气与CO2反应也可制备合成气,在10L 密闭容器中通入lmolCH4 与1molCO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示。
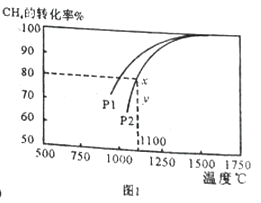
①1100℃、P2时气体混合后反应经过10min 至x 点的平衡,用CO 的变化量表示反应速率v(CO)=_____________;
②下列选项中能表示该反应已达到平衡状态的是____________;
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.c(CH4)=c(CO)
③由图1可知,压强P1_______P2 (填“大于”或“小于”);压强为P2时,在y点: v(正)____ v(逆) (填“大于”“小于”或“等于”)。求y点对应温度下的该反应的平衡常数K= __________。
(3)天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。
已知: 25℃时,NH3·H2O 的电离常数K=1.8×10-5,H2S 的两步电离常数分别为Ka1=1.3×10-7,Ka2=7.1×10-15。求NH4HS溶液中离子浓度大小关系_____________________(由大到小)。
(4)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= b kJ/mol。有研究者在催化剂、压强为5.0MPa 的条件下,由H2和CO 直接制备甲醚,结果如图2 所示。
CH3OCH3(g)+H2O(g) △H= b kJ/mol。有研究者在催化剂、压强为5.0MPa 的条件下,由H2和CO 直接制备甲醚,结果如图2 所示。
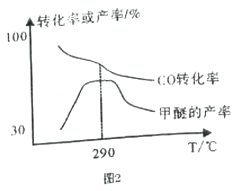
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是___________________________;
②b______0 (填“ >”或“<”或“=”) ,理由是___________________________。
【答案】 CH4(g)+H2O(g)=CO(g)+3H2(g) △H= + 206 kJ/mol 0.016mol/(L·min) C 小于 大于 1.6384 mol2/L2 c(NH4+)>c(HS—)>c(OH—)>c(H+)>c(S2—) 有副反应发生 < 平衡后,升高温度,甲醚的产率降低
【解析】试题分析:本题考查热化学方程式的书写,化学平衡的图像分析,化学平衡的标志,化学平衡常数的计算,溶液中离子浓度大小的比较。
(1)0.25molCH4与水蒸气完全反应制备“合成气”时吸收51.5kJ的热量,则1mol CH4与水蒸气完全反应制备“合成气”时吸收![]() =206kJ的热量,反应的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206kJ/mol。
=206kJ的热量,反应的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206kJ/mol。
(2)CH4和CO2反应制备合成气的反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①由图像知1100℃、P2时CH4的转化率为80%,则转化CH4物质的量为1mol![]() 80%=0.8mol,根据方程式知生成CO物质的量为1.6mol,υ(CO)=1.6mol
80%=0.8mol,根据方程式知生成CO物质的量为1.6mol,υ(CO)=1.6mol![]() 10L
10L![]() 10min=0.016mol/(L·min)。
10min=0.016mol/(L·min)。
② A,υ(H2)逆=3υ(CO)正表明逆反应速率大于正反应速率,反应没有达到平衡状态;B,该反应中所有物质都是气态,根据质量守恒定律,混合气体的质量始终不变,容器的容积不变,混合气体的密度始终不变,密闭容器中混合气体的密度不变不能说明反应达到平衡状态;C,该反应的正反应是气体分子数增大的反应,建立平衡过程中气体分子物质的量增大,密闭容器中总压强增大,平衡时气体分子物质的量不变,密闭容器中总压强不变,密闭容器中总压强不变能说明反应达到平衡状态;D,达到平衡时各物质的浓度保持不变,不一定相等,c(CH4)=c(CO)不能说明反应达到平衡状态;能说明反应达到平衡状态的是C项,答案选C。
③该反应的正反应为气体分子数增大的反应,增大压强平衡向逆反应方向移动,CH4的转化率减小,由图知在相同温度下P1时CH4的转化率大于P2,则P1小于P2。由图知,y点CH4转化率小于平衡时CH4的转化率,反应正向进行,υ(正)大于υ(逆)。y点的温度与x点的温度相同,y点平衡常数与x点相等,用三段式
CH4(g) + CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
c(起始)(mol/L)0.1 0.1 0 0
c(转化)(mol/L)0.1![]() 0.8=0.08 0.08 0.16 0.16
0.8=0.08 0.08 0.16 0.16
c(平衡)(mol/L)0.02 0.02 0.16 0.16
K=![]() =
=![]() =1.6384(mol/L)2。
=1.6384(mol/L)2。
(3)HS-在溶液中既存在电离平衡又存在水解平衡,HS-的水解离子方程式为HS-+H2O![]() H2S+OH-,HS-的水解平衡常数Kh=
H2S+OH-,HS-的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =7.69
=7.69![]() 10-8
10-8![]() Ka2(H2S),HS-的水解程度大于HS-的电离程度;由于K(NH3·H2O)
Ka2(H2S),HS-的水解程度大于HS-的电离程度;由于K(NH3·H2O)![]() Ka1(H2S),NH4+的水解程度小于HS-的水解程度,溶液呈碱性,则NH4HS溶液中离子浓度由大到小的顺序为c(NH4+)
Ka1(H2S),NH4+的水解程度小于HS-的水解程度,溶液呈碱性,则NH4HS溶液中离子浓度由大到小的顺序为c(NH4+)![]() c(HS-)
c(HS-)![]() c(OH-)
c(OH-)![]() c(H+)
c(H+)![]() c(S2-)。
c(S2-)。
(4)①290℃前,CO转化率和甲醚产率的变化趋势不一致,说明在290℃前有副反应发生。
②由图可见升高温度,CO转化率减小,甲醚产率减小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,ΔH![]() 0,即b
0,即b![]() 0。
0。

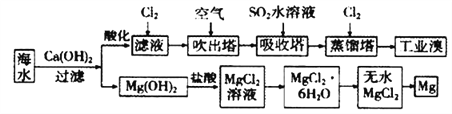
【题目】以硼镁泥为原料制取的硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:

(1)实验中需用3 mol·L-1的硫酸500 mL,若用98%的浓硫酸(ρ=1.84 g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化则至少需要氧化剂NaClO质量为______g;还有一种离子也会被NaClO氧化,该反应的离子方程式为______________________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有________、_________。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100 g水):
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)若实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为86.1 g,则MgSO4·7H2O的产率为__________。
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
① | 100 | 17.2 | 2.24 |
② | 200 | 8.00 | 4.48 |
③ | 400 | 0 | V |
下列说法正确的是( )
A.表中 V=7.84 L
B.原混合物粉末的质量为25.6 g
C.原混合物粉未中铁和铜的物质的量之比为2:3
D.实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1