题目内容
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
① | 100 | 17.2 | 2.24 |
② | 200 | 8.00 | 4.48 |
③ | 400 | 0 | V |
下列说法正确的是( )
A.表中 V=7.84 L
B.原混合物粉末的质量为25.6 g
C.原混合物粉未中铁和铜的物质的量之比为2:3
D.实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
【答案】A
【解析】解:由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)=4 n(NO),加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L,由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.3 mol电子),若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,设Fe和Cu的物质的量分别为xmol和ymol,则 ![]() ,解之得
,解之得 ![]() ,所以9.2gk中含铁2.8g,含铜的质量为:6.4g,所以第一次实验后剩余金属为Fe和Cu,而第二次实验后剩余金属只有铜,所以每一份固体混合物的质量为:
,所以9.2gk中含铁2.8g,含铜的质量为:6.4g,所以第一次实验后剩余金属为Fe和Cu,而第二次实验后剩余金属只有铜,所以每一份固体混合物的质量为: ![]() =25.6g,其中含铁为8.4+2.8=11.2g,含铜的质量为:6.4+8=14.4g,所以铁和铜的物质的量之比为
=25.6g,其中含铁为8.4+2.8=11.2g,含铜的质量为:6.4+8=14.4g,所以铁和铜的物质的量之比为 ![]() =8:9,
=8:9,
A、铁和铜完全反应消耗硝酸的物质的量为: ![]() +
+ ![]() =1.4mol,所以400mL的硝酸的物质的量为0.4×4=1.6mol,则硝酸过量,所以V=
=1.4mol,所以400mL的硝酸的物质的量为0.4×4=1.6mol,则硝酸过量,所以V= ![]() =7.84L,故A正确;
=7.84L,故A正确;
B、原混合物粉末的质量为25.6 g×3=76.8g,故B错误;
C、铁和铜的物质的量之比为: ![]() =8:9,故C错误;
=8:9,故C错误;
D、实验3所得溶液中硝酸的物质的量浓度为 ![]() =0.5mol/L,故D错误;
=0.5mol/L,故D错误;
故选A.
由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)=4 n(NO),加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L,由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.3 mol电子),若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第一次实验后剩余金属为Fe和Cu.第二次实验后剩余金属只有铜,由此分析解答.

【题目】下列有关实验的叙述正确的是
选项 | 实验方案 | 实验目的或结论 |
A | 将一片铝箔置于酒精灯外焰上灼烧 | 通过现象铝箔熔化而不滴落证明铝箔只发生了物理变化 |
B | 用玻璃棒蘸取氯水滴到pH试纸上,对比标准比色卡颜色 | 通过颜色变化可测定氯水的pH |
C | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 通过现象KMnO4褪色可证明乙烯能被酸性高锰酸钾氧化 |
D | 取少量溶液于试管中,加入NaOH溶液并加热,用湿润红色石蕊试纸检验产生的气体 | 通过试纸变色情况可检验原溶液中是否含有NH4+ |
A. A B. B C. C D. D
【题目】以硼镁泥为原料制取的硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:
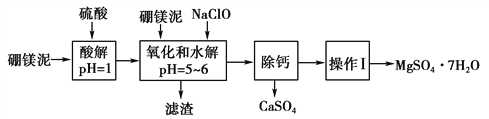
(1)实验中需用3 mol·L-1的硫酸500 mL,若用98%的浓硫酸(ρ=1.84 g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化则至少需要氧化剂NaClO质量为______g;还有一种离子也会被NaClO氧化,该反应的离子方程式为______________________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有________、_________。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100 g水):
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)若实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为86.1 g,则MgSO4·7H2O的产率为__________。