题目内容
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是________________。
(2)据上述流程,将10m3海水中溴元素(海水中Br-离子含量为64mg/L)转化为工业溴,整个流程中至少需要标准状况下Cl2的体枳为______L(忽略Cl2溶解)。
(3)从理论上考虑,下列物质也能吸收Br2的是_____。
A.H2O B.FeCl2 C.Na2SO3
(4)由无水氯化镁得到镁的化学方程式是_______。
(5)有同学认为:可以加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,以简化实验步骤,体现实验的简约性原则,你是否同意该同学的观点,理由为_______________。
【答案】 对溴元素进行富集 ![]() 179.2 BC
179.2 BC ![]() 不同意,因为MgO熔点高,熔融时耗费大量的能量增加生产成本,所以观点不正确。
不同意,因为MgO熔点高,熔融时耗费大量的能量增加生产成本,所以观点不正确。
【解析】分析:海水中加入氢氧化钙沉淀镁离子后过滤,在滤液中通入氯气是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应生成溴离子;再通入氯气将Br-氧化为Br2,两次转化的目的是对溴元素进行富集;氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体的操作是加热蒸发冷却结晶得到无水氯化镁,电解熔融氯化镁得到金属,据此解答。
详解:(1)根据以上分析可知经过2次Br-→Br2转化的目的是得到更多的溴单质,提取过程对溴元素进行富集;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,因此吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;
(2)若将10m3海水中的溴元素转化为工业溴,依据溴元素含量为64mg/L可计算10m3海水中含溴元素的质量是10000L×64g/L×10-3=640g;物质的量=640÷80g/mol=8mol,依据反应计算得到:2Br-+Cl2=Br2+2Cl-,消耗氯气物质的量为:4mol;提取过程中需要两次通入氯气实现溴离子被氧化,所以至少需要标准状况下Cl2的物质的量为8 mol,在标准状况下体积为8mol×22.4L/mol=179.2L;
(3)A.单质溴H2O中的溶解度很小,A错误;B.FeCl2具有还原性,能被溴氧化,因此可以吸收溴,B正确;C.Na2SO3具有还原性,能被溴氧化,因此可以吸收溴,C正确。答案选BC;
(4)镁是活泼的金属,电解熔融氯化镁得到金属镁和氯气,因此由无水氯化镁得到镁的化学方程式是MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。
(5)由于MgO熔点高,熔融时耗费大量的能量增加生产成本,所以观点不正确。

【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
① | 100 | 17.2 | 2.24 |
② | 200 | 8.00 | 4.48 |
③ | 400 | 0 | V |
下列说法正确的是( )
A.表中 V=7.84 L
B.原混合物粉末的质量为25.6 g
C.原混合物粉未中铁和铜的物质的量之比为2:3
D.实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
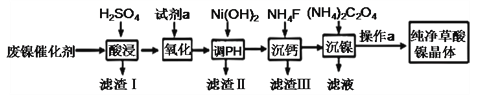
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。