题目内容
(6分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;事实上,反应的热量总小于理论值,为什么?
放出(2分),46.2(2分);该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值。(2分)
考查反应热的计算、化学反应能量变化的原因以及可逆反应的特点。在化学反应中断键是吸热的,形成化学键是放热的,如果断键吸收的能量高于形成化学键所放出的能量,则就是吸热反应,反之是放热反应。根据键能可知断键吸收的能量是436kJ×3+946 kJ=2254 kJ,形成化学键放出的能量是2×3×391 kJ=2346 kJ,所以是放热反应,即每生成2mol氨气放热是2346 kJ-2254 kJ=92 kJ,因此每生成1mol NH3放出46.kJ热量。因为氨气的合成是可逆反应,3魔力氢气和1mol氮气不可能生成2mol氨气,所以反应的热量总小于理论值。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
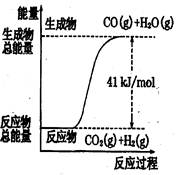
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
