题目内容
已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);
②H2SO4(aq)+Ba(OH)2(aq)=== BaSO4(s)+H2O(l);
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3·H2O(aq)=== CH3COONH4(aq)+H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);
②H2SO4(aq)+Ba(OH)2(aq)=== BaSO4(s)+H2O(l);
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3·H2O(aq)=== CH3COONH4(aq)+H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
| A.② | B.③ |
| C.②③④ | D.以上都不对 |
D
已知热化学反应方程式的意义为:强酸与强碱反应生成1mol H2O时放热57.3 kJ;
①中生成2mol H2O,故放热应为57.3×2 kJ;
②中不仅是强酸与强碱反应生成了1mol H2O,还包括生成BaSO4的反应,故反应热不等于57.3 kJ·mol-1;
③中的反应物有弱碱NH3·H2O;
④中是弱酸与弱碱的反应;故选D
①中生成2mol H2O,故放热应为57.3×2 kJ;
②中不仅是强酸与强碱反应生成了1mol H2O,还包括生成BaSO4的反应,故反应热不等于57.3 kJ·mol-1;
③中的反应物有弱碱NH3·H2O;
④中是弱酸与弱碱的反应;故选D

练习册系列答案
相关题目
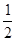 O2(g) = H2O(l);△H =-285.8kJ/mol
O2(g) = H2O(l);△H =-285.8kJ/mol
 2SO3(g) △H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为( )
2SO3(g) △H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为( ) 放出942kJ热量。由此判断下列说法正确的是( )
放出942kJ热量。由此判断下列说法正确的是( )