题目内容
某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g,碱石灰增重4.4g.该烃的气体对H2的相对密度是35.
(1)烃A的分子式为 .
(2)烃A燃烧的化学方程式为 .
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 (写出两种即可);其中一种分子中,所有碳原子都在同一平面内,用键线式表示它 ,它发生加聚反应的化学方程式为 .
(1)烃A的分子式为
(2)烃A燃烧的化学方程式为
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为
考点:有关有机物分子式确定的计算,有机物实验式和分子式的确定
专题:
分析:(1)某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g为水的质量,水的物质的量=
=0.1mol,碱石灰增重4.4g为二氧化碳的质量,其物质的量=
=0.1mol,根据原子守恒可知烃A的分子式为C5H10;
(2)烃完全燃烧生成二氧化碳与水;
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,还原双键确定A的可能结构;
其中一种分子中,所有碳原子都在同一平面内,其中有一种分子中,所有碳原子都在同一平面内,对应烯烃应为(CH3)2C=CH-CH3,据此解答.
| 1.8g |
| 18g/mol |
| 4.4g |
| 44g/mol |
(2)烃完全燃烧生成二氧化碳与水;
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,还原双键确定A的可能结构;
其中一种分子中,所有碳原子都在同一平面内,其中有一种分子中,所有碳原子都在同一平面内,对应烯烃应为(CH3)2C=CH-CH3,据此解答.
解答:
解:(1)某烃A 0.02mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加1.8g为水的质量,水的物质的量=
=0.1mol,碱石灰增重4.4g为二氧化碳的质量,其物质的量=
=0.1mol,根据原子守恒可知,烃A的分子中C原子数目=
=5、H原子数目=
=10,故烃A的式为C5H10,
故答案为:C5H10;
(2)烃C5H10完全燃烧生成二氧化碳与水,化学方程式为:2C5H10+15O2
10CO2+10H2O,
故答案为:2C5H10+15O2
10CO2+10H2O;
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,则A可能的结构简式为: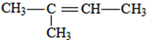 、
、 、
、 ;
;
以上结构简式中,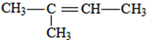 可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为:
可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为: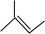 ,
,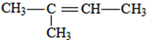 发生加聚反应的方程式为:
发生加聚反应的方程式为: ,
,
故答案为: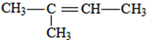 、
、 、
、 (任意两种);
(任意两种); ;
; .
.
| 1.8g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 0.1mol |
| 0.02mol |
| 0.1mol×2 |
| 0.02mol |
故答案为:C5H10;
(2)烃C5H10完全燃烧生成二氧化碳与水,化学方程式为:2C5H10+15O2
| 点燃 |
故答案为:2C5H10+15O2
| 点燃 |
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,则A可能的结构简式为:
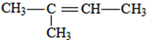 、
、 、
、 ;
;以上结构简式中,
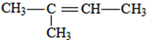 可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为:
可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为: ,
,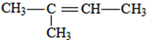 发生加聚反应的方程式为:
发生加聚反应的方程式为: ,
,故答案为:
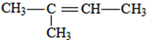 、
、 、
、 (任意两种);
(任意两种); ;
; .
.
点评:本题考查了有机物分子式确定、同分异构体等,侧重于同分异构体、有机物性质的考查,为高考常见题型,题目难度中等.

练习册系列答案
相关题目
已知某粒子的质子数,则可确定的( )
| A、中子数 | B、最外层电子数 |
| C、核电荷数 | D、相对原子质量 |
在常温、常压下,将10mL某气态烃与80mL氧气(过量)的混合物点燃燃烧,当恢复到原来的状况时,测得气体的体积为60mL,则该气态烃的化学式可能是( )
| A、C3H8 |
| B、C4H8 |
| C、C8H8 |
| D、C3H4 |
