题目内容
对于反应:N2+3H2═2NH3,当其他条件不变时,只改变一个反应条件,将生成NH3的反应速率的变化填入空格里(填“增大”、“减小”或“不变”):
| 编号 | 改变的条件 | 生成NH3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大N2的浓度 | |
| ④ | 使用催化剂 | |
| ⑤ | 压缩体积 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:影响化学反应速率的因素有温度、浓度、压强、催化剂等,从改变外界条件对活化分子的浓度或百分数的影响角度分析化学反应速率的变化.
解答:
解:①升高温度,活化分子的百分数增大,反应速率增大,故答案为:增大;
②②降低温度,活化分子百分数减小,反应速率减小,故答案为:减小;
③增大N2的浓度,反应物活化分子浓度增大,反应速率增大,故答案为:增大;
④使用催化剂,降低反应的活化能,活化分子百分数增大,反应速率增大,故答案为:增大;
⑤压缩体积,压强增大,反应物的浓度增大,活化分子浓度增大,反应速率增大,故答案为:增大.
②②降低温度,活化分子百分数减小,反应速率减小,故答案为:减小;
③增大N2的浓度,反应物活化分子浓度增大,反应速率增大,故答案为:增大;
④使用催化剂,降低反应的活化能,活化分子百分数增大,反应速率增大,故答案为:增大;
⑤压缩体积,压强增大,反应物的浓度增大,活化分子浓度增大,反应速率增大,故答案为:增大.
点评:本题考查外界条件对反应速率的影响,题目难度不大,注意外界条件对活化分子的影响,注重基础知识的积累.

练习册系列答案
相关题目
常温下把氨水滴到盐酸中,当c(NH4+)=c(Cl-)时,混合液的pH值( )
| A、等于7 | B、大于7 |
| C、小于7 | D、无法判断 |
下列说法正确的是( )
| A、一定温度压强下,△H<0、△S>0的反应一定能自发进行 |
| B、水解反应NH4++H2O?NH3?H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C、铅蓄电池放电时的负极和充电时的阴极均发生还原反应 |
| D、对于反应2H2O2?2H2O+O2↑,加入MnO2可加快O2的生成速率,提高H2O2转化率 |
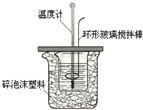 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: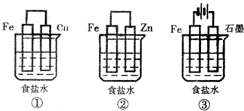
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: