题目内容
3.设NA表示阿伏加德罗常数,下列说法不正确的是( )| A. | 1.7克氢氧根离子(OH-)含有的电子数为 NA | |
| B. | 7克乙烯(CH2=CH2)所含的电子数为4NA | |
| C. | 标准状况下,22.4L一氧化碳所含的分子数为 NA | |
| D. | 1molFe分别与氯气和硫反应失去电子都是3NA |
分析 A、根据1mol氢氧根离子中含有10mol电子判断;
B、依据n=$\frac{m}{M}$计算物质的量,结合1个乙烯分子含有16个电子判断;
C、依据n=$\frac{V}{{V}_{m}}$计算物质的量,结合n=$\frac{N}{{N}_{A}}$计算分子数;
D、铁和氯气反应生成氯化铁,和硫反应生成硫化亚铁,一次计算电子转移数;
解答 解:A、1.7g氢氧根离子的物质的量为0.1mol,含有1mol电子,含有的电子数为NA,故A正确;
B、7克乙烯(CH2=CH2)物质的量=$\frac{7g}{28g/mol}$=0.25mol,1个乙烯分子含有16个电子所含的电子数=0.25mol×16×NA=4NA,故B错误;
C、n=$\frac{V}{{V}_{m}}$计算物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,所含的分子数为 NA,故C正确;
D、铁和氯气反应生成氯化铁,和硫反应生成硫化亚铁,1molFe分别与氯气和硫反应失去电子分别是3NA、2NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析应用主要是物质结构的分析应用,气体摩尔体积的条件分析判断,氧化还原反应电子转移的计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
13.X、Y均为短周期元素,X原子的最外层有3个电子,Y原子的最外层有6个电子,这两种元素形成的化合物的化学式是( )
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
14.下列说法不正确的是( )
| A. | 需要加热方能发生的反应不一定是吸热反应 | |
| B. | 反应是吸热还是放热取决于反应物和生成物所具有的总能量的相对大小 | |
| C. | 测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
11.下列关于化学与生产、生活的认识不正确的是( )
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | CO2是造成酸雨发生的罪魁祸首 | |
| C. | NO2是造成光化学烟雾的气体 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧张 |
18.NA 表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol.L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na 2S和Na2O2 的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol氧单质含有NA个O2 |
 . 黄绿色固体:
. 黄绿色固体: .
.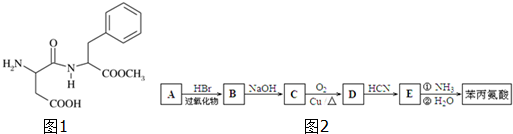
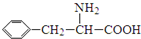 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示: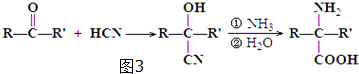
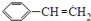 .
.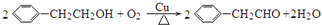 .
. .
.