题目内容
【题目】有反应:Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(1)___元素的化合价升高,则该元素的原子___电子,被___(填“氧化”或“还原”);而___元素的化合价降低,则该元素的原子___电子,被___(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了___反应,Al发生了__反应;___是氧化剂,__是还原剂,___是氧化产物,___是还原产物。
【答案】铝 失 氧化 铁 得 还原 还原 氧化 Fe2O3 Al Al2O3 Fe
【解析】
(1)在反应中,Al的化合价由0价升高到+3价,失去电子,被氧化,Fe的化合价由+3价降低到0价,得到电子,被还原。故答案为:铝,失,氧化,铁,得,还原。
(2)Fe2O3中铁的化合价降低,发生了还原反应,作氧化剂,生成的Fe是还原产物;Al的化合价升高,发生了氧化反应,作还原剂,生成的Al2O3是氧化产物。故答案为:还原,氧化,Fe2O3,Al,Al2O3,Fe。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程是_________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
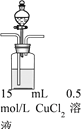
【题目】某兴趣小组欲探究SO2与Cu(OH)2 的反应。
实验 | 实验步骤 | 现象 |
| 步骤1:打开分液漏斗,向烧瓶中加入30mL 0.5 mol/LNaOH溶液 | I. 有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入SO2气体 | II. 静置后分层,上层溶液为淡绿色,底部有白色沉淀 |
(1)现象I中产生蓝色沉淀的离子方程式是___________。
(2)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
CuSO3 | CuCl | Cu2O | |
溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
性质 | 与酸反应 | 能溶于较浓的HCl溶液 | 酸性体系中不稳定,进一步反应生成Cu和Cu2+ |
并进行如下实验:
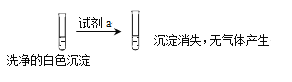
①试剂a是___________。
②现象II中生成白色沉淀的离子方程式是___________。
(3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依据的实验现象是_________。
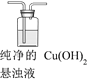
(4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。
①丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,_________(填操作和现象),证明已洗涤干净。再进行如下实验:
实验 | 实验步骤 | 现象 |
| 从左侧导管通入SO2气体 | III. 静置后分层,上层溶液为淡绿色,底部有砖红色沉淀。 |
②丙预测产物是Cu2O,取砖红色沉淀,洗涤后,_________(填操作和现象),证明产物是Cu2O。
(5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是_________。