��Ŀ����
����Ŀ��(I)���������ʽ��з���:��H��D��O2��O3���Ҵ�(C2H5OH)�����(CH3-O-CH3)�����������춡���C60����ʯ
(1)��Ϊͬλ�ص���_______(���š���ͬ)��
(2)��Ϊͬ�����������_______ ��
(3)��Ϊͬ���칹�����________��
(II)��ӦFe + H2SO4=== FeSO4+ H2���������仯������ͼ��ʾ:
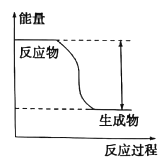
(1)�÷�ӦΪ _______��Ӧ(����ȡ����ȡ�)��
(2)��Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ���е���______(����ĸ)��
A.����ƬΪ���� B. ��ϡ����Ϊ98%��Ũ���� C.�ʵ������¶�
(3)����������Ӧ��Ƴ�ԭ��أ�ͭΪԭ���ijһ�����ϣ���ͭΪ_____(���������)�����ü��Ϸ����ĵ缫��ӦΪ___________��
���𰸡� �� �ڢ� �ۢ� ���� AC �� 2H++2e-==H2��
��������
(I)��1��������ͬ����������ͬ����������ͬ��������ͬһԪ�صIJ�ͬ���ػ�Ϊͬλ�أ���2��ͬ��Ԫ����ɵIJ�ͬ�ֵ��ʻ�Ϊͬ������������3��������ͬ����ʽ���ṹ��ͬ�Ļ����ﻥΪͬ���칹�壮
(II)��1�����ݷ�Ӧ���������������ϵ��������2������������������ʵ�Ӱ���������3��ͭ������ϡ���ṹ�ɵ�ԭ����У�����ʧ������������ͭ��������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��
(I)��1��H��D����������ͬ����������ͬ����Ϊͬλ�أ���ѡ�٣���2����O2��O3����C60����ʯ��ͬ��Ԫ����ɵIJ�ͬ�ֵ��ʣ���ѡ�ڢ�����3���Ҵ���C2H5OH������ѣ�CH3-O-CH3���������飨CH3CH2 CH2 CH3�����춡�飨CH3-CH��CH3��2����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬��ѡ�ۢܣ�
(II)��1����ͼ���֪����Ӧ�����������������������������Ը÷�ӦΪ���ȷ�Ӧ����2��A������ƬΪ���ۣ������˽Ӵ��������Ӧ��������A��ȷ��B����Ӧ��Ϊ�������ᷴӦ����ϡ����Ϊ98%��Ũ���� �������ۻ�����������������B����C�������¶ȣ���Ӧ��������C��ȷ����ѡAC����3��ͭ������ϡ���ṹ�ɵ�ԭ����У�����ʧ���ӷ���������Ӧ���������������ϵ缫��ӦʽΪFe-2e��=Fe2����ͭ�������������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H��+2e��=H2����

 �����������Ů��ͯ������ϵ�д�
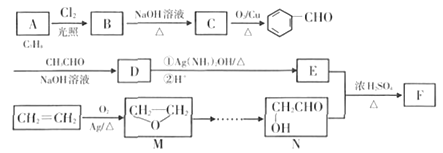
�����������Ů��ͯ������ϵ�д�����Ŀ������[KAl��SO4��2��12H2O]���������������й㷺��;������ˮ�ľ�������ֽ��ҵ����ʩ������ʳƷ��ҵ�ķ��ͼ��ȣ������������ķ��ϩ����ң���Al��Al2O3������SiO2��FeO��xFe2O3�����Ʊ������������������£�
�ش��������⣺

��1��������ˮ��ԭ���ǣ������ӷ��̱�ʾ��________________��
��2����������________��������������Ũ����________�����ˡ�ϴ�ӡ����
��3��������ҺA���Ƿ����Fe2+���Լ���________��ֻ��һ���Լ���
��4������ҺA�м��������ط�����Ӧ�����ӷ���ʽΪ����������Fe2+ ת��ΪFe3+��MnO4��ת��ΪMn2+��________________��
��֪�������������������pH���±���ʾ
Al��OH��3 | Fe��OH��2 | Fe��OH��3 | |
��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
ע���������ӵ���ʼŨ��Ϊ0.1mol��L��1
���ݱ������ݽ��͵�pH=3��Ŀ��________________��
��5����֪����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2������MnSO4������Ӧ�����ӷ���ʽΪ________________________��
����Ŀ��
(��)ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
���������ʵ����Ʊ�������ʵ��Ŀ��һ������գ�
ʵ�� ��� | �¶� ���棩 | ����ʯ ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
�� | 25 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 (II)ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ͢�̽��______________�Է�Ӧ���ʵ�Ӱ�� |
�� | 25 | �ֿ��� | _______ | |
�� | _____ | �ֿ��� | 2.00 | |
�� | 25 | ϸ���� | 2.00 |
(��)��2.5 mol A��2.5 mol B��Ϸ���2 L�ܱ������������Ӧ��3A(g)��B(g)![]() xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
��1����ƽ��ʱB��ת����Ϊ_____________________��
��2��x��ֵΪ___________________��
��3�����¶Ȳ��䣬��ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��____________����