题目内容
【题目】
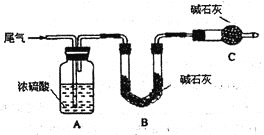
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。
【答案】 1.00 35 探究固体物质的表面积(答接触面亦可) 20% x=4 1.2
【解析】试题分析:(Ⅰ) 根据实验①和②探究浓度对反应速率的影响,所以实验①和②中硝酸浓度不同;实验①和③探究温度对反应速率的影响,实验①和③的温度不同;实验①和④碳酸钙颗粒大小不同;
(Ⅱ)根据三段式解题法,求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量.平衡时,生成的C的物质的量为0.2mol/(L﹒s)×5s×2L=2mol,
![]()
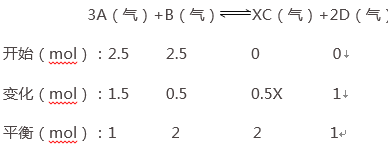
根据相关计算公式计算相关物理量。
解析:(Ⅰ) 根据实验①和②探究浓度对反应速率的影响,所以实验①和②中硝酸浓度不同,实验②中HNO3浓度为1.00mol/L;实验①和③探究温度对反应速率的影响,实验①和③的温度不同,实验③的温度选择35℃;实验①和④碳酸钙颗粒大小不同,实验①和④探究固体物质的表面积对反应速率的影响;
(Ⅱ)根据三段式法,平衡时,生成的C的物质的量为0.2mol/(L﹒s)×5s×2L=2mol,
![]()
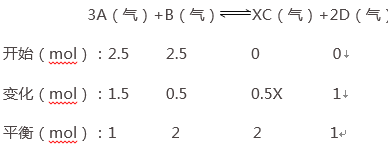
(1)达平衡时B的转化率为![]() 。
。
(2)![]() ,x=4。
,x=4。
(3)若温度不变,容器内气体的压强比等于物质的量比,![]()

【题目】一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)![]() B(g)+C(g) ΔH
B(g)+C(g) ΔH
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
A(g) | B(g) | C(g) | ||
Ⅰ | 387 | 0. 20 | 0. 080 | 0. 080 |
Ⅱ | 387 | 0. 40 | ||
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
下列说法不正确的是
A. 该反应的正反应为ΔH<0
B. 207℃,K=4
C. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
D. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短