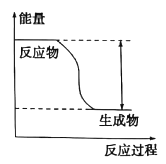
题目内容
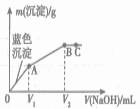
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )
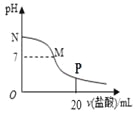
A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0mL
C. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
【答案】D
【解析】试题分析:A.M-N间溶液的pH大于7,一定是氨水过量的情况,存在c(NH4+)>c(Cl-)c(OH-)>c(H+),故A错误;B.M点对应的溶液显示中性,酸碱恰好反应生成氯化铵显示酸性,应该是氯化铵和氨水的混合物,即M点对应的盐酸体积小于10.0mL,故B错误;C.根据电荷守恒:pH=7溶液中有c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C错误;D.P点处的溶液是等物质的量浓度的盐酸和氯化铵的混合物,存在:2c(NH4+)+2c(NH3H2O)=c(Cl-),故D正确。故选D。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
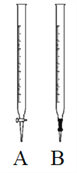
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。
(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。