题目内容
【题目】(1)相同物质的量浓度的①CH3COOH 溶液,②盐酸,c(H+)较大的是____________(填编号);CH3COOH 的电离方程式为____________。
(2)FeCl3溶液保存时需加少量____________(填“盐酸”或“硫酸”)。
(3)甲醇 CH3OH 是一种重要的化工原料,在生产中有着广泛的应用。合成 CH3OH 的一种 反应为:CO(g) + 2H2(g)![]() CH3OH (g)。一定条件下,将 1 mol CO 和 2 mol H2在 1L 容器中发生上述反应,经过 2 min 反应生成了 a mol CH3OH(反应前后体积不变)。
CH3OH (g)。一定条件下,将 1 mol CO 和 2 mol H2在 1L 容器中发生上述反应,经过 2 min 反应生成了 a mol CH3OH(反应前后体积不变)。
①此时 CO 的浓度为____________mol/L 。
②2min 内用 H2 表示该反应的速率为 v(H2) =____________mol/(L·min)。
③升高温度,反应的平衡常数 K 减小,则该反应为____________(填“吸热反应”或“放热反应”)。
【答案】② CH3COOH![]() CH3COO- + H+ 盐酸 1–a a 放热反应
CH3COO- + H+ 盐酸 1–a a 放热反应
【解析】
(1) CH3COOH为弱酸,发生部分电离;盐酸为强酸,发生完全电离。
相同物质的量浓度的①CH3COOH 溶液,②盐酸,c(H+)较大的是盐酸。答案为②
CH3COOH为弱酸,发生部分电离,所以反应物与生成物间应出现“![]() ”
”
电离方程式为CH3COOH![]() CH3COO-+ H+。答案为:CH3COOH
CH3COO-+ H+。答案为:CH3COOH![]() CH3COO-+ H+
CH3COO-+ H+
(2)因为FeCl3是强酸弱碱盐,易发生水解,所以溶液保存时需加少量酸抑制水解,但同时需注意,加入的酸不能影响它的性质,故只能加盐酸。答案为盐酸
(3)我们利用三段式进行计算:
CO(g) + 2H2(g)![]() CH3OH (g)
CH3OH (g)
起始量 1mol 2mol 0
变化量 a mol 2a mol a mol
平衡量 (1-a)mol 2(1-a)mol a mol
①此时CO的浓度为![]() 答案为:1–a
答案为:1–a
②2min 内用H2表示该反应的速率为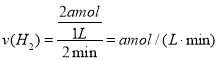 答案为 a
答案为 a
③升高温度,反应的平衡常数 K 减小,说明升温平衡逆向移动,则正反应为放为反应。
答案为:放热反应