题目内容
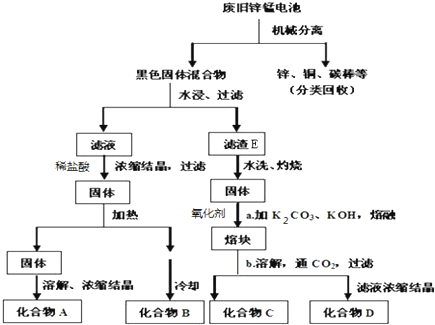
20.如图所示,试分析确定各有机物的结构简式.已知:(1)A、B、D可发生银镜反应.
(2)B、G蒸气的密度相同
AHCHO(甲醛),BHCOOH(甲酸),CCH3OH(甲醇),DHCOOC2H5(甲酸乙酯),ECH3COOCH3(乙酸甲酯),FCH3COOH(乙酸),GCH3CH2OH(乙醇).
分析 A能发生银镜反应,说明A中含有醛基,A发生氧化反应生成B,B为羧酸,B能发生银镜反应,则A为HCHO、B为HCOOH,A发生还原反应生成C为CH3OH,B、C分别发生酯化反应生成D、E,D、E是同分异构体,D酸性条件下水解生成甲酸和G,B、G蒸气密度相对,说明二者摩尔质量相等,则G为CH3CH2OH;D为HCOOC2H5,D和E互为同分异构体,则E为CH3COOCH3,乙酸甲酯酸性条件下水解生成F和C,则F为CH3COOH,据此分析解答.
解答 解:A能发生银镜反应,说明A中含有醛基,A发生氧化反应生成B,B为羧酸,B能发生银镜反应,则A为HCHO、B为HCOOH,A发生还原反应生成C为CH3OH,B、C分别发生酯化反应生成D、E,D、E是同分异构体,D酸性条件下水解生成甲酸和G,B、G蒸气密度相对,说明二者摩尔质量相等,则G为CH3CH2OH;D为HCOOC2H5,D和E互为同分异构体,则E为CH3COOCH3,乙酸甲酯酸性条件下水解生成F和C,则F为CH3COOH,
通过以上分析知,A、B、C、D、E、F、G分别是A:HCHO(甲醛)、B:HCOOH(甲酸)、C:CH3OH(甲醇)、D:HCOOC2H5(甲酸乙酯)、E:CH3COOCH3(乙酸甲酯)、F:CH3COOH(乙酸)、G:CH3CH2OH(乙醇),
故答案为:A:HCHO(甲醛);B:HCOOH(甲酸);C:CH3OH(甲醇);D:HCOOC2H5(甲酸乙酯);E:CH3COOCH3(乙酸甲酯);F:CH3COOH(乙酸);G:CH3CH2OH(乙醇).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,以甲酸的银镜反应为突破口采用正逆结合的方法进行推断,注意结合反应条件及题给信息进行推断,题目难度不大.

已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
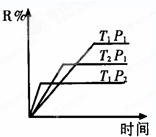 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
【实验Ⅰ】用如下装置(已省略夹持装置)制NaNO2.
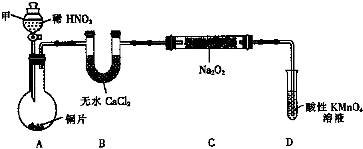
已知:2NO+Na2O2═2NaNO2; 2NO2+Na2O2═2NaNO3
(1)仪器甲的名称是分液漏斗.装置B的作用是干燥NO.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度,需要对上述实验装置的A与B间进行改进,请作图表示其改进措施(图中须标出所用试剂名称)
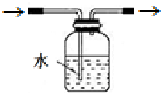 .
.【实验Ⅱ】利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为120mg•kg-1
(5)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
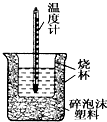 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: ;
;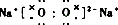 .
.