题目内容
9.电池是人类生产和生活中重要的能量来源,回答下列问题:(i)回收利用废旧普通锌锰电池工艺如图(不考虑旧电池中实际存在的少量其他金属).普通锌锰电池总反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
已知MnOOH不溶于水;Zn(NH3)2Cl2 溶于水和盐酸.
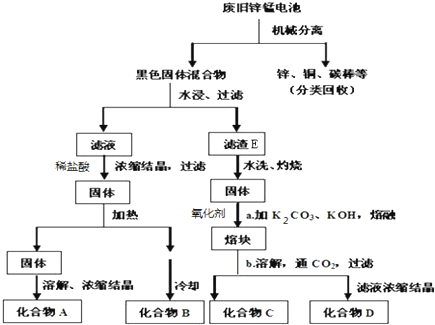
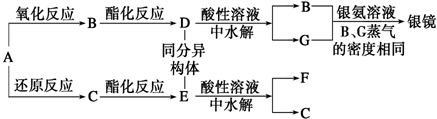
(1)图中产物的化学式分别为AZnCl2,BNH4Cl,滤渣E含MnO2和MnOOH.
(2)操作a中得到熔块的主要成分是K2MnO4.操作b中绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2+2CO32-.
(ii)燃料电池是一种高效、环境友好的发电装置.
(1)氢氧燃料电池具有无污染等优点,但储氢技术是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiHⅡLiH+H2O=LiOH+H2↑
①Ⅰ中的氧化剂是H2,反应Ⅱ中的还原剂是LiH;
②已知LiH固体的密度为0.8g/cm3.用锂吸收112L(标准状况)H2,吸收的H2体积与生成的LiH体积比值是1.13×103;
③由②生成的LiH与水反应放出的氢气用作电池燃料,若能量利用率为60%,则导线中通过电子的物质的量为12mol;
(2)一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷(C2H6)和氧气.电池的负极反应为:C2H6-14e-+18OH-=2CO32-+12H2O; 放电一段时间后,正极周围的pH升高(填升高、降低或不变).
分析 (i)Zn(NH3)2Cl2 溶于水和盐酸,所以废电池经机械分离后,加水溶解后溶液中的成分是Zn(NH3)2Cl2,再加稀盐酸溶解,浓缩结晶得到氯化铵和氯化锌的固体,氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌,MnOOH不溶于水,所以机械分离后的黑色固体溶于水过滤,得滤渣E的成份应为MnO2和MnOOH,绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰;
(ii)(1)①从化合价的变化的角度分析;
②根据反应的电极方程式计算;
③根据实际参加反应的氢气以及电极反应式计算;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,根据电极反应可知电极周围pH的变化.
解答 解:(i)Zn(NH3)2Cl2 溶于水和盐酸,所以废电池经机械分离后,加水溶解后溶液中的成分是Zn(NH3)2Cl2,再加稀盐酸溶解,浓缩结晶得到氯化铵和氯化锌的固体,氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌,MnOOH不溶于水,所以机械分离后的黑色固体溶于水过滤,得滤渣E的成份应为MnO2和MnOOH,绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,
(1)根据上面的分析可知,A为氯化锌,B为氯化铵,E为MnO2和MnOOH,
故答案为:ZnCl2;NH4Cl;MnO2和MnOOH;
(2)绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,
故答案为:3MnO42-+2CO2=2MnO4-+MnO2+2CO32-;
(ii)(1)①Ⅰ中H从零价降至-1价,作氧化剂,Ⅱ中LiH的H从-1升至H2中的零价,作还原剂,故答案为:H2;LiH;
②由反应I,112L(标准状况)H2即5mol,当吸收5molH2时,则生成10molLiH,V=$\frac{m}{ρ}$=$\frac{10×7.9}{0.8×1{0}^{3}}$L=9.875×10-2L,所以$\frac{V(H{\;}_{2})}{V(LiH)}$=$\frac{112}{9.875×1{0}^{-2}}$=1.13×103,
故答案为:1.13×103;
③10mol LiH可生成10mol H2,实际参加反应的H2为10mol×60%=6mol,1molH2转化成1molH2O,转移2mol电子,所以6molH2可转移12mol的电子,
故答案为:12mol;
(2)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O,正极上氧化剂即氧气得电子发生还原反应生成氢氧根离子,所以正极周围pH升高,
故答案为:C2H6-14e-+18OH-=2CO32-+12H2O;升高.
点评 本题考查了化学与技术、原电池原理、电极方程式的书写、化学电源的工作原理及有关计算,综合性较强,题目难度较大,注意原电池电极反应式的书写以及从电子守恒的角度计算.

| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 氯气和氢氧化钠溶液或石灰乳反应得到的含氯化合物都具有漂白性 | |
| C. | 光导纤维遇强酸会“断路” | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |

| A. | CH3OH | B. | C3H8 | C. | C2H4 | D. | CH4 |
| A. | H2O | B. | PCl5 | C. | CCl4 | D. | CH4 |