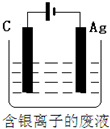
题目内容
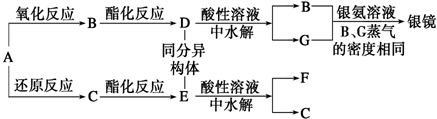
10.亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂.某化学兴趣小组进行如下实验.【实验Ⅰ】用如下装置(已省略夹持装置)制NaNO2.
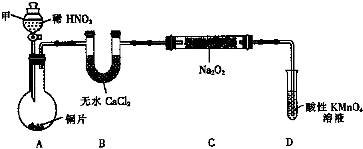
已知:2NO+Na2O2═2NaNO2; 2NO2+Na2O2═2NaNO3
(1)仪器甲的名称是分液漏斗.装置B的作用是干燥NO.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
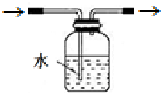
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度,需要对上述实验装置的A与B间进行改进,请作图表示其改进措施(图中须标出所用试剂名称)
 .
.【实验Ⅱ】利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为120mg•kg-1
(5)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
分析 (1)仪器甲的名称是分液漏斗;NO中混有水蒸气,水能与过氧化钠反应;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,根据电子守恒配平方程式即可;
(3)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(4)溶液体积加倍,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg•kg-1,则此泡菜样品中NaNO2的含量为 120mg•kg-1;
(5)根据维生素C的作用结合(5)的计算结果来回答.
解答 解:(1)仪器甲的名称是分液漏斗;NO中混有水蒸气,水能与过氧化钠反应,所以装置B的作用是干燥NO,故答案为:分液漏斗,干燥NO;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差,
故答案为: ;
;
(4)步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg•L-1,则此泡菜样品中NaNO2的含量为 120mg•L-1,故答案为:120;
(5)要和前面的实验方案做对比试验,同样可以是先取5mL甲待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比④色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:
| 实验操作 | 实验现象 |
| 取5mL待测液X,加入维生素C,振荡,加入1mL M溶液, 加蒸馏水至10 mL,与④号色阶比较 | 与④号色阶比较紫红色更浅 |
点评 本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度较大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
18.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法.其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子.如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、…然后测定其质荷比β.设H+的质荷比为1,某有机物样品的质荷比如图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能( )

| A. | CH3OH | B. | C3H8 | C. | C2H4 | D. | CH4 |
5.巴豆酸的结构式为:CH3-CH=CH-COOH 现有:①氯化氢;②溴水; ③纯碱溶液; ④丙醇; ⑤酸化的高锰酸钾溶液.试根据其结构特点判断在一定条件下能与巴豆酸反应的物质组是( )
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
15.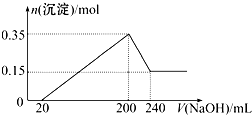 将一定质量的镁和铝混合物投入200mL 硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL 硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
 将一定质量的镁和铝混合物投入200mL 硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL 硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 镁和铝的总质量为9g | |
| B. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为2.5mol/L | |
| D. | 镁和铝混合物投入硫酸中生成的氢气在标准状况下的体积为11.2L |
2.对下列实验操作和现象描述不正确的是( )
| A. | 过滤操作中一定要用到的玻璃仪器有烧杯、玻璃棒、漏斗 | |
| B. | 进行蒸发操作,当有大量晶体析出时,改用小火将溶液直接蒸干 | |
| C. | 用CCl4溶液将碘从水溶液中萃取出,经静置分层分液漏斗的下层为紫色 | |
| D. | 在蒸馏操作中,一般要在蒸馏瓶中加入几粒碎瓷片防止溶液暴沸 |
19.在下列分子结构中,原子的最外层电子都能满足8电子稳定结构的是( )
| A. | H2O | B. | PCl5 | C. | CCl4 | D. | CH4 |
20.一定温度下2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如图所示.下列有关说法不正确的是( )
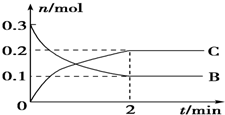

| A. | X=2 | |
| B. | 反应开始2min内,v(C)=0.05 mol•L-1•min-1 | |
| C. | 2min后,升高温度平衡向右移动 | |
| D. | 当容器内混合气体压强不再改变时,反应体系达到化学平衡状态 |