题目内容
3.对叔丁基苯酚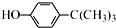 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:步骤l:组装仪器,用量筒量取2.2mL叔丁基氯(过量),称取1.6g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗.
步骤2:向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,反应有气体放出.
步骤3:反应结束后,向A中加入8mL水和1mL浓盐酸,即有白色固体析出.
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8g.
(1)仪器A和B的名称分别为三颈烧瓶;冷凝管.
(2)步骤2中发生主要反应的化学方程式为
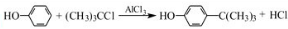 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
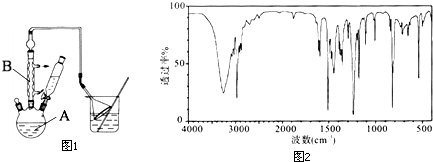
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.(3)图1中倒扣漏斗的作用是防止倒吸.苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用酒精洗涤.
(4)步骤4中用石油醚重结晶提纯粗产物,试简述重结晶的操作步骤:将粗产物加到烧杯中,加入适量石油醚,加热使粗产品溶解,随后趁热过滤,将滤液静置,冷却结晶,滤出晶体
(5)实验结束后,对产品进行光谱鉴定,谱图结果如图2.该谱图是B (填字母).
A.核磁共振氢谱图 B.红外光谱图 C.质谱图
(6)下列仪器在使用前必须检查是否漏液的是BCD(填选项字母).
A.量筒 B.容量瓶 C.滴定管 D.分液漏斗 E.长颈漏斗
(7)本实验中,对叔丁基苯酚的产率为70.6%.(请保留三位有效数字)
分析 (1)根据实验装置图可知仪器名称;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,据此写方程式;反应为放热反应,会导致叔丁基氯挥发;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚以溶于酒精;
(4)用石油醚重结晶提纯粗产物,可以将粗产物加到烧杯中,加入适量石油醚,加热使粗产品溶解,随后趁热过滤,将滤液静置,冷却结晶,滤出晶体;
(5)根据谱图的结构特点可知,该图为测定官能团的;
(6)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏;
(7)根据反应 可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)根据实验装置图可知仪器A为三颈烧瓶,B为冷凝管,故答案为:三颈烧瓶;冷凝管;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,反应方程式为 ,反应为放热反应,会使叔丁基氯挥发,从而导致产率下降,
,反应为放热反应,会使叔丁基氯挥发,从而导致产率下降,
故答案为: ;由于叔丁基氯挥发导致产率降低;
;由于叔丁基氯挥发导致产率降低;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚以溶于酒精,所以苯酚沾到皮肤上可用酒精洗涤,
故答案为:防止倒吸;酒精;
(4)用石油醚重结晶提纯粗产物,可以将粗产物加到烧杯中,加入适量石油醚,加热使粗产品溶解,随后趁热过滤,将滤液静置,冷却结晶,滤出晶体,
故答案为:将粗产物加到烧杯中,加入适量石油醚,加热使粗产品溶解,随后趁热过滤,将滤液静置,冷却结晶,滤出晶体;
(5)根据谱图的结构特点可知,该图为测定官能团的,所以是红外光谱图,故选B;
(6)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏,故选BCD;
(7)根据反应:
94 150
1.6g x,
x=$\frac{1.6×150}{94}$=2.55g,则对叔丁基苯酚的产率为$\frac{1.8g}{2.55g}$×100%=70.6%;
故答案为:70.6%.
点评 本题有机物的合成为载体,考查化学实验,题目综合性较大,涉及对实验原理的理解、对装置的分析评价、对实验条件的选择控制、实验方案设计、物质分离提纯、化学计算等,难度中等,是对学生综合能力的考查.

 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案(1)配制0.1mol/L的盐酸溶液
| 量筒量取浓盐酸体积/mL | 应选用量筒的规格(可供选择的规格10mL、25mL、50mL) | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
| ①2.1mL | ②25 mL | ③250 mL | ④烧杯、玻璃棒、胶头滴管、量筒 |
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.E,继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切.
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中偏低;
②若加蒸馏水时不慎超过了刻度偏低;
③若定容时俯视刻度线偏高;
④用量筒量取浓盐酸时仰视偏高.
 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
| 装置序号 | ① | ② | ③ | ④ |
| 各仪器装置图 | 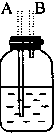 | 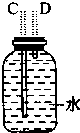 | 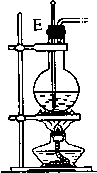 |  |

(1)若所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号):③接①接②接④.其中①与②装置相连时,玻璃导管连接(用装置中字母表示)应是B接D.
(2)若加热时间过长,温度过高生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是氢氧化钠溶液.
(3)装置③中碎瓷片的作用是防止暴沸,浓H2SO4的作用是脱水剂和催化剂,此装置中发生的主要反应的化学方程式是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(4)实验开始时首先应检查装置的气密性,实验结束时,应先拆去A处(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯.
(5)实验结束时若装置④中水的体积在标况下为0.112L,则实验中至少消耗乙醇0.005mol.
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 硅材料广泛用于光纤通讯 | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
 (Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(Ⅰ)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答: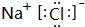 .
.