题目内容
15.结合已学知识,并根据下列一组物质的特点回答相关问题.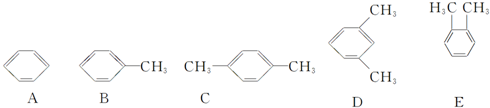
(1)邻二甲苯的结构简式为E(填编号,从A~E中选择).
(2)A、B、C之间的关系为b(填序号).
a.同位素 b.同系物 c.同分异构体 d.同素异形体
(3)请设计一个简单实验来检验A与D,简述实验操作过程:取少量A、D分别装入两支试管中,向两支试管中滴入少量酸性KMnO4溶液,振荡,若溶液褪色,则为间二甲苯;若溶液不褪色,则为苯.
(4)有机物同分异构体的熔沸点高低规律是“结构越对称,熔沸点越低”,根据这条规律,判断C、D、E的熔沸点由高到低的顺序:E>D>C(填编号).
分析 (1)E为邻二甲苯;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
(3)苯不能被酸性KMnO4溶液氧化,间二甲苯能被酸性KMnO4溶液氧化;
(4)根据结构越对称,熔沸点越低解题.
解答 解:(1)C为对二甲苯,D为间二甲苯,E为邻二甲苯,故答案为:E;
(2)A、B、C的结构简式中都含有苯环,分子式依次相差1个“CH2”,符合通式CnH2n-6(n≥6),所以它们互为同系物,故答案为:b;
(3)苯不能被酸性KMnO4溶液氧化,间二甲苯能被酸性KMnO4溶液氧化,故可用之检验,故答案为:取少量A、D分别装入两支试管中,向两支试管中滴入少量酸性KMnO4溶液,振荡,若溶液褪色,则为间二甲苯;若溶液不褪色,则为苯;
(4)对二甲苯的对称性最好,邻二甲苯的对称性最差,故熔沸点由高到低:E>D>C,故答案为:E>D>C.
点评 本题考查有机物的结构与性质,注意习题中的信息分析物质的性质,把握官能团与性质的关系为解答的关键,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
18.一定条件下,分别以KMnO4、KClO3、H2O2、HgO(HgO分解产生O2)为原料制取O2.当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比是( )
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
19.下列各组中的两种溶液:①氢氧化钠、硫酸铁;②稀硫酸、澄清石灰水;③氯化钠、硝酸银;④盐酸、四烃基合铝酸钠;⑤氯化铝、氢氧化钠;⑥碳酸钠、稀盐酸;⑦硝酸银、氨水 不需另加其他试剂,只需两两混合即可鉴别的是( )
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
20.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
请回答:
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为 .
.
(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为
 .
.(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
7.(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
(1)E-的结构示意图是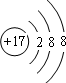 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
4.下列各组物质中所含氧原子的物质的量相同的是( )
| A. | 0.3 mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1 mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O与0.1 mol C6H12O6 | |
| D. | 0.2mol SO3与0.3mol SO2 |
5.(1)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之为6:3:2.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
试计算:①10.0g此样品中铜的物质的量0.0625mol.②样品中氧化亚铁的质量分数60%.③所用硫酸溶液溶质的物质的是浓度2.8mol/l.
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
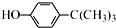 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: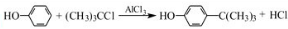 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.