题目内容
【题目】甲醇既是重要的化工原料,又可作为燃料,还可以作为燃料电池的原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(KJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=_____kJ·mol-1。
(2)已知:
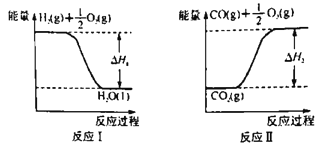
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
(3)以CH4和H2O为原料,通过下列反应也可以制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)= =CH3OH (g)ΔH=-129.0 kJ·mol-1
CH4(g)+H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________.
【答案】 -99 +41 2ΔH1-ΔH2-ΔH3 略 CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77kJ·mol-1
【解析】(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1;
(2)甲醇的燃烧热为ΔH3为反应③,图示反应1、II分别为反应①、反应②,根据盖斯定律,CO(g)+2H2(g) ![]() CH3OH(l)的ΔH=反应①×2—反应②—反应③=2ΔH1-ΔH2-ΔH3;
CH3OH(l)的ΔH=反应①×2—反应②—反应③=2ΔH1-ΔH2-ΔH3;
水的物质的量为0.2mol,由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.2mol,由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1可知0.2molH2燃烧放出的热量为57.16KJ,则CO燃烧放出的热量为113.74KJ-57.16KJ=56.58KJ,设混合气体中CO的物质的量为x,则
CO(g)+1/2 O2(g)=CO2(g)△H=-283kJmol-1
283KJ
x 56.58KJ
解得x=0.2mol,即n(CO)=0.20mol,原混合气体中H2和CO的物质的量均为0.2mol,H2和CO的物质的量之比为1:1。
(3)CH4(g)+H2O(g)反应生成CH3OH(g)和H2(g)的ΔH=+206.0 kJ·mol-1+(-129.0 kJ·mol-1)=+77kJ·mol-1。CH4(g)+H2O(g)==CH3OH(g)+ H2(g),ΔH=+77kJ·mol-1。


