题目内容
3.一种氢氧燃料电池的电解液为KOH溶液.下列有关该电池的叙述不正确的是( )| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| D. | H2通入的一极为正极 |
分析 氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,据此分析.
解答 解:A.正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变,故B正确;
C.负极电极反应式为H2-2e-+2OH-=2H2O,正极电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,故C正确;
D.通入氢气的一极为电池的负极,发生氧化反应,故D错误;
故选D.
点评 本题考查了化学电源新型电池,根据正负极上得失电子确定电极,再结合电解质溶液酸碱性书写电极反应式,如果电解质溶液呈酸性,则正负极电极反应就改变,为易错点.

练习册系列答案
相关题目
13.研究NO2、SO2、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
①T1℃时,该反应的平衡常数K=0.56(保留两位小数).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.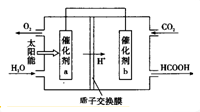 3×10-8mol•L-1)
3×10-8mol•L-1)
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.
 3×10-8mol•L-1)
3×10-8mol•L-1)(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
14.为了除去CO2中含有少量的SO2气体,可以使气体通过( )
| A. | Na2CO3溶液 | B. | H2SO4溶液 | C. | NaHCO3溶液 | D. | Ba(OH)2溶液 |
11.反应下列原子或离子核外电子未成对电子数最多的是( )
| A. | N | B. | Ni | C. | Cr | D. | Cu+ |
15.下列说法正确的是( )
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
12.航天飞船可用肼(电子式为 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 该动力源的突出优点之一是反应产物对环境无污染 | |
| B. | 液态肼燃烧生成1 mol N2时放出的热量为20.05 kJ | |
| C. | 该反应中肼作氧化剂 | |
| D. | 肼和过氧化氢中的化学键类型相同 |
13.分子式为C6H12O2,属于乙酸乙酯同系物的同分异构体共有( )
| A. | 12种 | B. | 16种 | C. | 20种 | D. | 24种 |
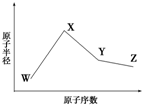 已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体
已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体