题目内容
3.硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂.图1是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性的实验装置.将铜片置于具支试管的底部,用分液漏斗往具支试管中加入约10mL浓硝酸,具支试管中发生反应的离子方程式为Cu+4H++2NO3-═Cu2++2H2O+NO2↑,实验中观察到能证明浓硝酸具有强氧化性的现象是溶液变为蓝色、试管中有红棕色气体生成.
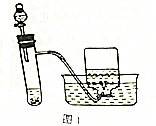
分析 Cu和浓硝酸反应生成可溶性的硝酸铜、NO2和H2O,NO2是红棕色气体,能和H2O反应生成硝酸和NO,NO是无色气体,硝酸铜溶液是蓝色溶液,据此分析解答.
解答 解:Cu和浓硝酸反应生成可溶性的硝酸铜、NO2和H2O,NO2是红棕色气体,能和H2O反应生成硝酸和NO,NO是无色气体,硝酸铜溶液是蓝色溶液,离子方程式为Cu+4H++2NO3-═Cu2++2H2O+NO2↑,该反应中N元素化合价由+5价变为+4价,所以浓硝酸体现强氧化性,看到的现象是:溶液变为蓝色、试管中有红棕色气体生成,
故答案为:Cu+4H++2NO3-═Cu2++2H2O+NO2↑;溶液变为蓝色、试管中有红棕色气体生成.
点评 本题考查铜和浓硝酸的反应,浓硝酸具有强氧化性,能氧化较不活泼金属单质,易错点是实验现象的描述,注意化学用语的正确运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.在反应A(s)+B(g)═2C(g)中,可使反应速率增大的措施是( )
①升高温度②降低压强③通入B气体④增加A的量⑤将块状固体A磨成粉末.
①升高温度②降低压强③通入B气体④增加A的量⑤将块状固体A磨成粉末.
| A. | ①③⑤ | B. | ①②④ | C. | ①④⑤ | D. | ①②③④⑤ |
11.下列实验方案不合理的是( )
| A. | 用pH试纸测定氯水的pH | |
| B. | 用焰色反应鉴别NaCl和KNO3 | |
| C. | 用AgNO3溶液鉴别NO2和Br2蒸气 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的HCl杂质气体 |
18. 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
2.化学与生产、生活息息相关,下列说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
6.下列说法正确的是( )
| A. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| B. | 酸碱中和滴定常用的指示剂有酚酞、甲基橙和石蕊试液 | |
| C. | 除去Fe(OH)3胶体中的NaCl时,可将其装在用半透膜做的袋子里,放在流动的蒸馏水中,该分离方法称为渗析 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
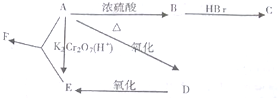
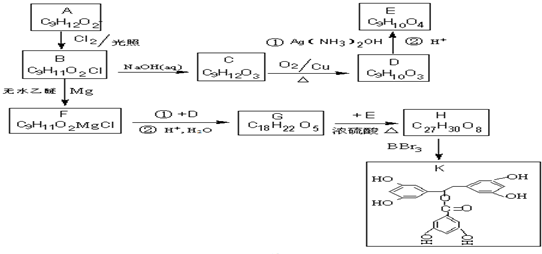
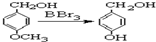
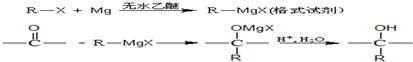
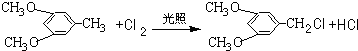 .
. ;
;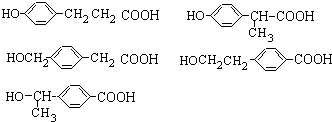 (任意3个);.
(任意3个);.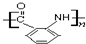 .(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).
.(无机试剂任选.用流程图表示:写出反应物、产物及主要反应条件).