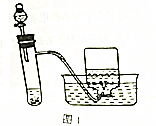
题目内容
11.下列实验方案不合理的是( )| A. | 用pH试纸测定氯水的pH | |
| B. | 用焰色反应鉴别NaCl和KNO3 | |
| C. | 用AgNO3溶液鉴别NO2和Br2蒸气 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的HCl杂质气体 |
分析 A.氯水中含有强氧化性的次氯酸,能够将试纸漂白;
B.NaCl和KNO3无色溶液的焰色分别为黄色、紫色;
C.二氧化氮和水反应以及溴蒸气溶于水有颜色;AgBr为浅黄色沉淀,以此来鉴别;
D.盐酸与碳酸氢钠反应生成二氧化碳.
解答 解:A.氯水中含有次氯酸,次氯酸能够漂白pH试纸,所以不能用pH试纸测定氯水的PH值,故A错误;
B.NaCl和KNO3无色溶液的焰色分别为黄色、紫色,现象不同,可鉴别,故B正确;
C.氧化氮和溴蒸气都是红棕色气体,二氧化氮与水反应生成硝酸和无色的一氧化氮气体,而溴蒸气溶于水,溶液颜色为橙红色,二者现象不同,故可鉴别,故C正确;
D.盐酸与碳酸氢钠反应生成二氧化碳,可除去混有的HCl,故D正确.
故选A.
点评 本题考查化学实验评价,为高频考点,把握物质的化学性质和物理性质的差异为解答的关键,题目难度不大,注意物质的性质的区别.

练习册系列答案
相关题目
1.下列金属治炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | ||
| C. | Fe3O4+3CO$\frac{\underline{\;高温\;}}{\;}$3Fe+3CO2 | D. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O |
2.已知一个原子的质量为m(一个12C原子的质量为n),则该原子的相对原子质量可用m、n表示为( )
| A. | $\frac{12n}{m}$ | B. | $\frac{m}{12n}$ | C. | $\frac{12m}{n}$ | D. | $\frac{m}{n}$ |
19.如图是铅蓄电池构造示意图,下列说法不正确的是( )
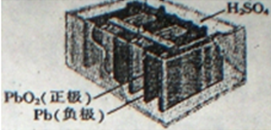

| A. | 铅蓄电池属于二次电池,充电时电能转化为化学能 | |
| B. | 电池工作时,电子由Pb板通过导线流向PbO2板 | |
| C. | 电池工作时,负极反应为:Pb-2e-═Pb2+ | |
| D. | 电池工作时,H+移向PbO2板 |
6.一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是( )
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
16.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述不正确的是,( )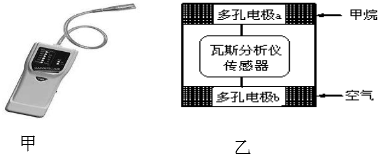

| A. | 电极b是正极,内电路中O2-由电极b流向电极a | |
| B. | 电极a的反应式为:CH4+4O2--8e-═CO2+2H2O | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| D. | 当固体电解质中有1mol O2-通过时,电子转移2mol |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、Cl-、Na+ | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | c(H+)=1.0×10-13 mol•L-1溶液中:C6H5O-、K+、SO42-、Br- | |
| D. | 能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
15.下列有关实验的解释或说明正确的是( )
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |