题目内容
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
2SO3(g)的平衡常数为( )
| A.3.2×103 | B.1.6×103 | C.8.0×102 | D.4.0×102 |
A
解析

练习册系列答案
相关题目
对于可逆反应4 NH3(g)+5O2(g) 4NO(g)+6 H2O(g)下列叙述正确的是
4NO(g)+6 H2O(g)下列叙述正确的是
| A.达到化学平衡时,4v正(O2)= 5v逆(NO) |
| B.若单位时间内生成x mol NO,同时消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大 |
| D.在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态 |
已知2SO2(g)+O2(g)  2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
| A.在2 min内,v(SO2)=0.25 mol·L-1·min-1 |
| B.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小 |
| C.在1 min时,c(SO2)+c(SO3)=0.01 mol·L-1 |
| D.若恒温恒压下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,平衡后反应放热小于0.025a kJ |
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是( )
A.2SO2+O2 2SO3 2SO3 |
B.CO+H2O(g) CO2+H2 CO2+H2 |
C.CO2(g)+H2O H2CO3 H2CO3 |
D.Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
温度为T ℃时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g)??N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol·L-1·s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D.T ℃时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )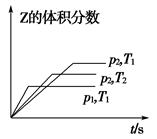
甲 乙
| A.图甲,p1>p2,a<3 |
| B.图甲,T1<T2,Q>0 |
| C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 |
| D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强 |
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
| | A | B |
| 研究 目的 | 压强对反应的影 响(p2>p1) | 温度对反应的影响 |
| 图示 | 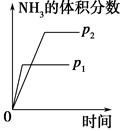 | 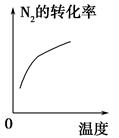 |
| 研究 目的 | 平衡体系增加N2 对反应的影响 | 催化剂对反应的影响 |
| 图示 |  | 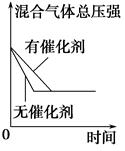 |
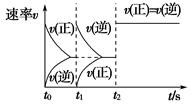
某密闭容器中发生如下反应:2X(g)+Y(g) Z(g) ΔH<0。如图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是( )
Z(g) ΔH<0。如图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是( )
| A.t3时减小了压强 |
| B.t5时增大了压强 |
| C.t6时刻后反应物的转化率最低 |
| D.t4~t5时该反应的平衡常数大于t6时反应的平衡常数 |
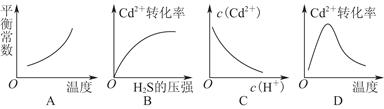
 CdS(s)+2H+(aq) ΔH<0
CdS(s)+2H+(aq) ΔH<0