题目内容
(12分)碱式碳酸镁密度小,是橡胶制品的优良填料。可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的含镁复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在 120℃干燥得到碱式碳酸镁产品。
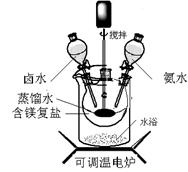
(1)①搅拌的目的是 ,②选择水浴加热方式,其优点是: 。
(2) 40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: 。
(3)40℃时,开始滴加卤水的目的是
(4)碱式碳酸镁产品中镁的质量分数(ω(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有: 。
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有: 。
①充分灼烧后,剩余固体的质量 ②灼烧时,测算得的二氧化碳的体积(已换算成标准状况) ③灼烧时的温度和时间 ④碱式碳酸镁的密度

(1)①搅拌的目的是 ,②选择水浴加热方式,其优点是: 。
(2) 40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为: 。
(3)40℃时,开始滴加卤水的目的是
(4)碱式碳酸镁产品中镁的质量分数(ω(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有: 。
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有: 。
①充分灼烧后,剩余固体的质量 ②灼烧时,测算得的二氧化碳的体积(已换算成标准状况) ③灼烧时的温度和时间 ④碱式碳酸镁的密度
(1)使反应物充分混合接触,提高反应速率。 反应物均匀受热
(2)MgCO3·(NH4)2CO3·H2O+H2O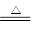 MgCO3·3H2O↓+ CO2↑+2NH3↑
MgCO3·3H2O↓+ CO2↑+2NH3↑
(3)吸收复盐热解放出的NH3和部分CO2。
(4)容量瓶(一定规格)、胶头滴管
(5)①②
(2)MgCO3·(NH4)2CO3·H2O+H2O
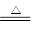 MgCO3·3H2O↓+ CO2↑+2NH3↑
MgCO3·3H2O↓+ CO2↑+2NH3↑ (3)吸收复盐热解放出的NH3和部分CO2。
(4)容量瓶(一定规格)、胶头滴管
(5)①②
(1)搅拌可以使反应物充分混合接触,提高反应速率。水浴加热能使反应物受热均匀。
(2)铵盐不稳定,受热易分解,方程式为MgCO3·(NH4)2CO3·H2O+H2O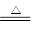 MgCO3·3H2O↓+ CO2↑+2NH3↑。
MgCO3·3H2O↓+ CO2↑+2NH3↑。
(3)由于复盐分解产生氨气和CO2气体,所以加入卤水,可以吸收复盐热解放出的NH3和部分CO2,以便生成沉淀。
(4)准确配制一定物质的量浓度除了以上仪器外,还需要一定规格的容量瓶和胶头滴管(定容需要)。
(5)若要确定其组成,则需要化合物中碳元素的含量和氢元素的含量。碱式碳酸镁分解生成氧化镁、CO2和水。所以①②是必须的,③④不需要。
(2)铵盐不稳定,受热易分解,方程式为MgCO3·(NH4)2CO3·H2O+H2O
 MgCO3·3H2O↓+ CO2↑+2NH3↑。
MgCO3·3H2O↓+ CO2↑+2NH3↑。(3)由于复盐分解产生氨气和CO2气体,所以加入卤水,可以吸收复盐热解放出的NH3和部分CO2,以便生成沉淀。
(4)准确配制一定物质的量浓度除了以上仪器外,还需要一定规格的容量瓶和胶头滴管(定容需要)。
(5)若要确定其组成,则需要化合物中碳元素的含量和氢元素的含量。碱式碳酸镁分解生成氧化镁、CO2和水。所以①②是必须的,③④不需要。

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
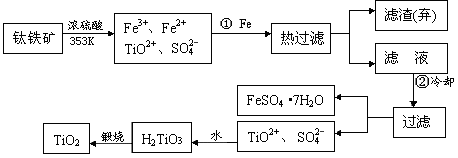
 TiCl4
TiCl4 Ti
Ti 
 ,含
,含 、
、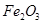 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: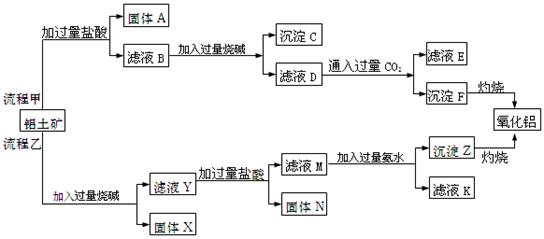
 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。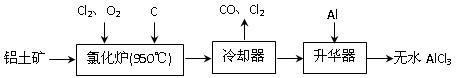
 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。