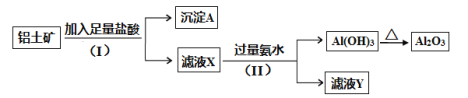
题目内容
【题目】下列关于元素金属性、非金属性强弱判断不正确的是( )
A. 高温下2C+SiO2![]() 2CO↑+Si,说明非金属性:C>Si
2CO↑+Si,说明非金属性:C>Si
B. 碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C. 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D. 氧化性:Cu2+>Na+,说明金属性:Na>Cu
【答案】A
【解析】
A.这个反应比较特殊,这个反应能够进行,是因为高温下生成了气态的一氧化碳,一氧化碳是非常的稳定,又能脱离反应体系,才能使反应平衡右移,与非金属性无关,故A错误;
B.同浓度下碱性:KOH>Mg(OH)2,碱性越强对应元素的金属性越强,所以金属性K>Mg,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,其单质与氢气化合越容易,所以氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性F>Cl,故C正确;
D.金属离子的氧化性越强,则金属单质的还原性越弱,因为氧化性:Cu2+>Na+,则金属性Na>Cu,故D正确,
故选A。

练习册系列答案
相关题目