题目内容
【题目】某铝土矿主要含Al2O3和SiO2。某课题组以此为原料回收氧化铝,设计实验流程如下:
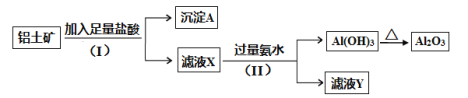
(1)步骤(I)中分离溶液和沉淀的操作名称是_____,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是_____。
(2)沉淀A中一定含有_________(用化学式表示),该物质属于________(填 “酸性”或“碱性”)氧化物。
(3)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式___________________。
(4)实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用__________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(5)取5.4g铝土矿进行实验,最后得到氧化铝5.1g,则该铝土矿中铝的含量为____________(假设实验过程没有损失)。
【答案】过滤 漏斗 SiO2 酸性 Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+ C 50%
【解析】
根据题给流程和信息知铝土矿加入足量盐酸反应,发生反应:Al2O3+6HCl=2AlCl3+3H2O,过滤,沉淀A为SiO2,滤液X为氯化铝溶液;向滤液X中加入过量氨水,发生反应:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,过滤,滤液Y为氯化铵和氨水的混合液,沉淀氢氧化铝受热分解生成氧化铝,据此答题。
(1)步骤(I)中分离溶液和沉淀的操作名称是过滤,过滤要用到的玻璃仪器除烧杯和玻璃棒外,还需要漏斗,故答案为:过滤,漏斗。
(2)沉淀A中一定含有SiO2,该物质属于酸性氧化物,故答案为:SiO2,酸性。
(3)氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝和氯化铵,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(4)氢氧化铝为两性氢氧化物,能溶于强酸、强碱,为保证铝元素全部转化为氢氧化铝沉淀,实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用二氧化碳,选C,故答案为:C。
(5)5.1g氧化铝的物质的量为:5.1g÷102g/mol=0.05mol,则n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g,则该铝土矿中铝的含量为2.7g/5.4g×100%=50%,故答案为:50%。

【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D