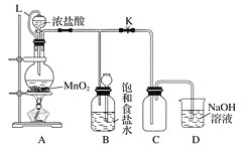
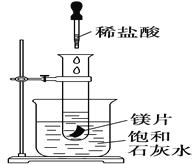
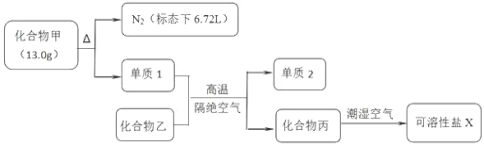
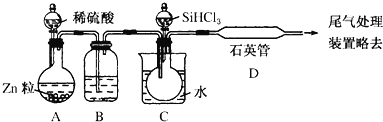
题目内容
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)△H=-akJ/mol,已知: (a、b、c均大于零)
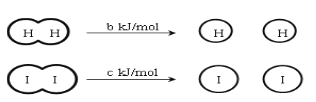
下列说法正确的是
A.碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞
B.断开2molHI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
【答案】B
【解析】
A.反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应,能引发化学反应的碰撞称之为有效碰撞;单位时间内反应物分子间有效碰撞的次数越多其反应速率越大,故A错误;
B.△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=b kJ/mol+c kJ/mol-2E(H-I)=-akJ/mol,得到断开2mol H-I键所需能量E(H-I)约为(a+b+c) kJ,故B正确;
C.反应是放热反应,反应物的总能量大于生成物的总能量,即相同条件下,1mol H2(g)和1mol I2(g)总能量大于2mol HI(g)的总能量,故C错误;
D.反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D错误;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
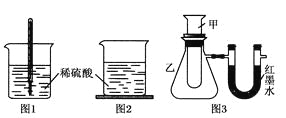
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红
墨水液面高低判断某反应是吸热反应还是放热反应。
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写 出该反应的离子方程式:___________。
(2)方案一中,温度升至最大值后又下降的原因是___________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为________,说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量