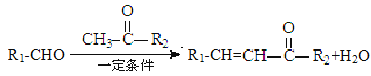题目内容
【题目】下列说法正确的是()
A.硫化氢分子的电子式:![]()
B.CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0
C.向含nmolNH4Al(SO4)2的溶液中,逐滴加入含nmolNaOH的溶液,离子反应方程式为:NH4++OH-=NH3·H2O
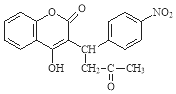
D.分子式为C5H12O的饱和一元醇与和它相对分子质量相同的饱和一元羧酸进行酯化反应,生成的酯共有16种(不考虑立体异构)
【答案】D
【解析】
A. 硫化氢属于共价分子,电子式为: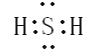 ,故A错误;
,故A错误;
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)该反应为熵减的反应△S<0,若能自发进行,则△G=△H-T△S<0,则△H<0,故B错误;
CH2Cl2(l)+HCl(g)该反应为熵减的反应△S<0,若能自发进行,则△G=△H-T△S<0,则△H<0,故B错误;
C. 氯离子与氢氧根离子按照物质的量之比1:3恰好完全反应生成氢氧化铝沉淀,所以当n(Al3+):n(OH-)=1:1时,应该生成氢氧化铝沉淀,离子反应方程式为:Al3++3OH-═Al(OH)3↓,故C错误;
D. 分子式为C5H12O的饱和一元醇为戊醇,戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,所以该有机物的可能结构有8种;C5H12O的分子量为88,和它相对分子质量相同的一元羧酸为丁酸,丙基有2种结构,故生成的酯为16,故D正确。
故选D。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
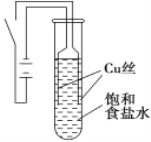
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性