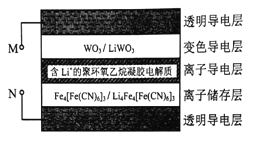
��Ŀ����
����Ŀ����֪ X��Y��Z��Q��R��E����ǰ������Ԫ���У�ԭ������X��Y��Z��Q��R��E����ṹ��������Ϣ�����
Ԫ�� | �ṹ��������Ϣ |
X | ԭ�ӵ�L����s����������p������ |
Y | ԭ�Ӻ����L����3��δ�ɶԵ��� |
Z | �ؿ��к�������Ԫ�� |
Q | ���ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���� |
R | �˵������Y��Q�ĺ˵����֮�� |
E | N�ܲ���ֻ��һ�����ӣ�K��L��M����������� |
�������Ϣ�ش��й����⣺
��1��д��Ԫ��Y��ԭ�Ӻ���۵����Ų�ͼ�� �� X��һ���⻯����Է�������Ϊ26��������еĦҼ���м��ļ���֮��Ϊ ��
��2��X��Y��Z����Ԫ�صĵ�һ�������ɸߵ��͵�����Ϊ��дԪ�ط��ţ� ��
��3��X��ZԪ�طֱ�����Ԫ���γɵ���������У��е�ϸߵ�Ϊ��д��ѧʽ�� �� ԭ���� ��
��4��XZ��Y2���ڵȵ����壬д��������XZ�Ľṹʽ�� ��
��5��R��һ�������Ļ�ѧʽΪRCl36H2O����֪0.01mol RCl36H2O��ˮ��Һ���ù�����������Һ����������0.02mol AgCl�������������������� ��
A.[R��H2O��6]Cl3
B.[R��H2O��5Cl]Cl2H2O
C.[R��H2O��4Cl2]Cl2H2O
D.[R��H2O��3Cl3]3H2O
��6��������ESO4��ˮ��Һ����ε��백ˮ��������ɫ��������Ӧ�����ӷ���ʽΪ�� �� �����μӰ�ˮ�������������ܽ⣬ �õ�����ɫ��Һ��д��Ӧ�����ӷ���ʽΪ�� ��
��7��Ԫ��E�ĵ��ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ�� 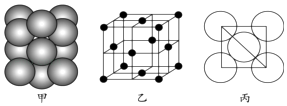
����֪��Ԫ�ص�ԭ�Ӱ뾶Ϊd cm�����ԭ������ΪM��NA���������ӵ���������þ�����ܶ�Ϊgcm��3������ĸ��ʾ����
���𰸡�
��1��![]() ��3��2
��3��2
��2��N��O��C
��3��H2O��ˮ���Ӽ�����γ����,ʹ�е�����
��4��C��O
��5��B
��6��Cu2++2NH3?H2O=Cu��OH��2��+2NH4+�� Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH��
��7��![]()
���������⣺��֪ X��Y��Z��Q��R��E����ǰ������Ԫ���У�ԭ������X��Y��Z��Q��R��E��Xԭ�ӵ�L����s����������p����������L�㺬��4�����ӣ�ΪCԪ�أ�Z�ǵؿ��к�������Ԫ�أ���ZΪOԪ�أ�Yԭ�Ӻ����L����3��δ�ɶԵ��ӣ���ԭ������С��O����C����ZΪNԪ�أ�Q�ĵ��ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���ӣ���MΪClԪ�أ�R�ĺ˵������Y��Q�ĺ˵����֮�ͣ���R�ĺ˵����=7+17=24��ΪCrԪ�أ�E��N�ܲ���ֻ��һ�����ӣ�K��L��M����������ӣ�����������Ϊ2+8+18+1=29��ΪCuԪ�أ���1��YΪNԪ�أ���ԭ������Ϊ7�������5�����ӣ�Ϊ2s22p3��Ϊ2s��2p���ӣ���2p�����ӦΪ3�������ӣ��۵��ӹ���Ų�ʽΪ�� ![]() ��XΪCԪ�أ�C��һ���⻯����Է�������Ϊ26���û�����Ϊ��Ȳ����Ȳ�����к���3���Ҽ���2���м���������еĦҼ���м��ļ���֮��Ϊ3��2��
��XΪCԪ�أ�C��һ���⻯����Է�������Ϊ26���û�����Ϊ��Ȳ����Ȳ�����к���3���Ҽ���2���м���������еĦҼ���м��ļ���֮��Ϊ3��2��
���Դ��ǣ� ![]() �� 3��2�� ��2��ͬ������ԭ����������Ԫ�ص�һ�����ܳ�����ǿ�ᣬ����Ԫ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ�����ܣ�N��O��C��
�� 3��2�� ��2��ͬ������ԭ����������Ԫ�ص�һ�����ܳ�����ǿ�ᣬ����Ԫ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ�����ܣ�N��O��C��
���Դ��ǣ�N��O��C����3��X��ZԪ�طֱ�����Ԫ���γɵ��������ֱ�ΪCH4��H2O������ˮ���Ӽ�����γ������ʹ�е����ߣ�����ˮ�ķе�ϸߣ�
���Դ��ǣ�H2O�� ˮ���Ӽ�����γ������ʹ�е����ߣ���4�����ݵȵ�����ԭ������֪������CO��N2��Ϊ�ȵ����壬�������ӵĽṹʽΪN��N����CO�Ľṹʽ��C��O��
���Դ��ǣ�C��O�� ��5��RCl36H2OΪCrCl36H2O����������֪���Ȼ�����CrCl36H2O�����Ȼ��������ʵ���֮����1��2�������������غ�֪����CrCl36H2O��ѧʽ�к���2��������Ϊ������ӣ�ʣ���1������������ԭ�ӣ������Ȼ�����CrCl36H2O���Ļ�ѧʽ����Ϊ[Cr��H2O��5Cl]Cl2H2O��
���Դ��ǣ�B����6��ESO4ΪCuSO4��������CuSO4��ˮ��Һ����ε��백ˮ������������ͭ��ɫ��������Ӧ�����ӷ���ʽΪ��Cu2++2NH3H2O=Cu��OH��2��+2NH4+�������μӰ�ˮ�������������ܽ�����=[Cu��NH3��4]2+���õ�����ɫ��Һ����Ӧ�����ӷ���ʽΪ��Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH����
���Դ��ǣ�Cu2++2NH3H2O=Cu��OH��2��+2NH4+�� Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH������7��EΪCu������ͼ�ҿ�֪��������Cuԭ����ĿΪ��8�� ![]() +6��
+6�� ![]() =4������������4��
=4����������Ϊ��4�� ![]() g��Cu��ԭ�Ӱ뾶Ϊd cm�����ⳤΪ��4d cm��
g��Cu��ԭ�Ӱ뾶Ϊd cm�����ⳤΪ��4d cm�� ![]() =2
=2 ![]() d cm����Cu�������ܶȦ�=
d cm����Cu�������ܶȦ�= ![]() =
= ![]() =
= ![]() g��cm��3��
g��cm��3��
���Դ��ǣ� ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij�о���ѧϰС���������ͼ��ʾһ��ʵ��װ������ȡ����������A��ʢ���Ҵ���Ũ����ʹ���Ļ��Һ��C��ʢ�б���̼������Һ��
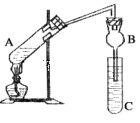
��֪�����Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е�(��) | 34.7 | 78.5 | 117.9 | 77.1 |
��1��Ũ�����������________________________________��
��2�����ι�B�������������⣬��һ��Ҫ������____________________________��
��3����Ӧ�����õ��Ҵ��ǹ����ģ���Ŀ����___________________��
��4��C�б���̼������Һ������__________________________________________��
��5����C�з����������������ʹ�õ�һ��������______________________������������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ��뱥���Ȼ�����Һ�����__________���ټ�����ˮ�����ƣ�Ȼ����������ռ�77�����֣��Եõ��ϴ���������������