题目内容
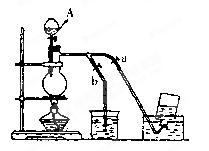
下图是一套制取并验证氯气部分化学性质的实验装置。
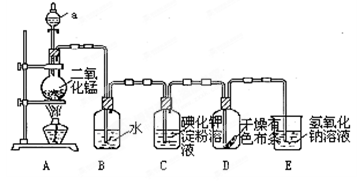
回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为__ __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_ ___色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____ ________。
(5)装置E的作用是_____ ___。并写出该反应的化学方程式: 。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ______ ______;

回答下列问题:反应的方程式:MnO2+4HCl(浓)
 MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑(1)装置A中,仪器a盛有的试剂为__ __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_ ___色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____ ________。
(5)装置E的作用是_____ ___。并写出该反应的化学方程式: 。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ______ ______;
(1)浓盐酸
(2) < Cl2+H2O≒HCl+HClO
(3)蓝色
(4)能,因为湿润的氯气有漂白性
(5) 吸收多余的氯气 Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
(2) < Cl2+H2O≒HCl+HClO
(3)蓝色
(4)能,因为湿润的氯气有漂白性
(5) 吸收多余的氯气 Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
考查氯气的制取及性质
(1)反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,故分液漏斗中装的是浓盐酸
(2)由于反应Cl2+H2O≒HCl+HClO生成了酸,故溶液呈酸性,pH<7
(3)由于反应生成碘单质:Cl2+2I-=2Cl-+I2,使淀粉呈蓝色
(4)由于氯气为湿润的,故有次氯酸生成,具有漂白性,干燥的有色布条能褪色.
(5)氯气有毒,一般用碱液吸收:Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
(1)反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,故分液漏斗中装的是浓盐酸
(2)由于反应Cl2+H2O≒HCl+HClO生成了酸,故溶液呈酸性,pH<7
(3)由于反应生成碘单质:Cl2+2I-=2Cl-+I2,使淀粉呈蓝色
(4)由于氯气为湿润的,故有次氯酸生成,具有漂白性,干燥的有色布条能褪色.
(5)氯气有毒,一般用碱液吸收:Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O

练习册系列答案
相关题目
 偏高”“偏低”或“无影响”)。
偏高”“偏低”或“无影响”)。
 ;
;