题目内容
【题目】碳和氮的化合物与人类生产、生活密切相关.
(1)C、CO、CO2在实际生产中有如下应用:a.2C+SiO2 ![]() Si+2CO b.3CO+Fe2O3
Si+2CO b.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
c.C+H2O ![]() CO+H2 d.CO2+CH4
CO+H2 d.CO2+CH4 ![]() CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 .
(2)有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2 , 为搞清该方法对催化剂的影响,查得资料:
则:①不用通入O2氧化的方法除去CO的原因是 .
②SO2(g)+2CO(g)=S(s)+2CO2(g)△H= .
(3)汽车尾气中含大量CO和氮氧化物(NO2)等有毒气体.①活性炭处理NO的反应:C(s)+2NO(g)N2(g)+CO2 (g)△H=﹣akJmol﹣1(a>0)
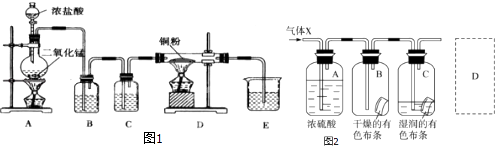
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: . 
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO2)反应生成无毒尾气,其化学方程式是 .
(4)利用CO2与H2反应可合成乙醚.以KOH为电解质溶液,组成乙醚﹣﹣﹣﹣空气燃料电池,该电池工作时其负极反应式是 .
(5)电解CO制备CH4和W,工作原理如图2所示,生成物W是 , 其原理用电解总离子方程式解释是 .
【答案】
(1)d
(2)避免O2与Ni反应再使其失去催化作用;﹣270kJ/mol
(3)b;2xCO+2NOx ![]() 2xCO2+N2
2xCO2+N2
(4)CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O
(5)NaHCO3;4CO+3CO32﹣+5H2O=6HCO3﹣+CH4↑
【解析】解:(1)观察四个反应方程式可见,只有反应d中参加反应的物质全部转化为一种物质,故原子利用率最高,所以答案是:d;(2)①Ni能与氧气反应也会导致其中毒,所以答案是:避免O2与Ni反应再使其失去催化作用;②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(﹣2×283)kJmol﹣1=﹣566kJmol﹣1 , (i)由图II可知,S(s)+O2(g)=SO2(g)△H=﹣296kJmol﹣1 , (ii)
(i)﹣(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣563﹣(﹣298)=﹣270kJmol﹣1 , 所以答案是:﹣270kJ/mol;(3)①C(s)+2NO(g)N2(g)+CO2 (g)△H=﹣akJmol﹣1 , 此反应为放热反应,且为气体体积不变的反应,
a.增加排气管长度,不能改变NO的转化率,故a错误;
b.增大尾气排放口,相当于移出部分氮气和二氧化碳气体,利于平衡右移,故b正确;
c.添加合适的催化剂,只改变化学反应速率,不会增加NO的转化率,故c错误;
d.升高排气管温度,温度升高,平衡左移,不利于NO转化,故d错误;
所以答案是:b;
②反应物是一氧化碳和NOx , 生成物无毒,故生成物之一是氮气和二氧化碳,根据反应前后元素种类不变,化学方程式为:2xCO+2NOx ![]() 2xCO2+N2 ,
2xCO2+N2 ,
所以答案是:2xCO+2NOx ![]() 2xCO2+N2;(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O,
2xCO2+N2;(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O,
所以答案是:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O;(5)由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32﹣+5H2O=6HCO3﹣+CH4↑,所以答案是:NaHCO3;4CO+3CO32﹣+5H2O=6HCO3﹣+CH4↑.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
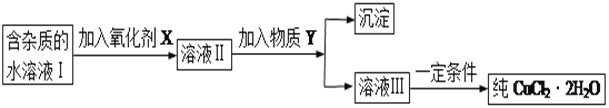
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)