题目内容
[化学——选修化学与技术](15分)
硫酸是工业生产中最为重要的产品之一。
(1)工业上制硫酸主要分为_________、________、_________三个阶段。
(2)下列是第二阶段反应的有关实验数据,请选择最合适的生产条件____________。

(3)现在欲提高反应速率和SO2的转化率,下列措施可行的是( )
(4)硫酸生产的尾气中含有少量SO2,可有石灰水吸收后,再用硫酸处理。此过程涉及的化学反应方程式为__________________,______________。
(5)若进入第二阶段所用设备中气体的体积分数为:SO27%、O211%、N282%。现有100体积这样的混合气体在反应后变成96.7体积,则反应后混合气体中N2和SO3的体积比为___________,此时SO2转化率为__________。
硫酸是工业生产中最为重要的产品之一。
(1)工业上制硫酸主要分为_________、________、_________三个阶段。
(2)下列是第二阶段反应的有关实验数据,请选择最合适的生产条件____________。

(3)现在欲提高反应速率和SO2的转化率,下列措施可行的是( )
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(5)若进入第二阶段所用设备中气体的体积分数为:SO27%、O211%、N282%。现有100体积这样的混合气体在反应后变成96.7体积,则反应后混合气体中N2和SO3的体积比为___________,此时SO2转化率为__________。
(1)造气 接触氧化 吸收(各1分)
(2)400 0.4Mpa (或常压)(各1分) (3)B(2分)
(4)SO2+Ca(OH)2=CaSO3+H2O CaSO3+H2SO4=CaSO4+SO2+H2O
(5)410:33(或82:6.6) 94.3%(各2分)
(2)400 0.4Mpa (或常压)(各1分) (3)B(2分)
(4)SO2+Ca(OH)2=CaSO3+H2O CaSO3+H2SO4=CaSO4+SO2+H2O
(5)410:33(或82:6.6) 94.3%(各2分)
(1)考查工业制硫酸的原理。工业上制硫酸主要分为造气、接触氧化、吸收三个阶段。
(2)根据表中数据可知,温度越高转化率越低,所以综合考虑温度对反应速率、化学平衡及催化剂的活性等,选择400℃。压强越大转化率越高,但压强太高,对设备的要求更高,且再常压下反应物的转化率已经很高,所以采用常压即可。
(3)A中反应物的浓度不变,反应速率和转化率都不变。增大氧气都浓度,反应速率增大,平衡向正反应方向移动,转化率增大,B正确。催化剂只能改变反应速率,但不能影响平衡状态,C不正确。降低温度反应速率降低,D不正确,答案选B。
(4)SO2是酸性氧化物,能和石灰水反应,生成亚硫酸钙。亚硫酸钙和硫酸反应又产生SO2,有关方程式为SO2+Ca(OH)2=CaSO3+H2O、CaSO3+H2SO4=CaSO4+SO2+H2O。
(5)考查根据方程式的有关计算,反应的方程式为
2SO2+O2 2SO3 △V
2SO3 △V
2 1 2 1
6.6 3.3 6.6 100-96.7=3.3
所以反应后混合气体中N2和SO3的体积比为82︰6.6
SO2的转化率是6.6÷7×100%=94.3%。
(2)根据表中数据可知,温度越高转化率越低,所以综合考虑温度对反应速率、化学平衡及催化剂的活性等,选择400℃。压强越大转化率越高,但压强太高,对设备的要求更高,且再常压下反应物的转化率已经很高,所以采用常压即可。
(3)A中反应物的浓度不变,反应速率和转化率都不变。增大氧气都浓度,反应速率增大,平衡向正反应方向移动,转化率增大,B正确。催化剂只能改变反应速率,但不能影响平衡状态,C不正确。降低温度反应速率降低,D不正确,答案选B。
(4)SO2是酸性氧化物,能和石灰水反应,生成亚硫酸钙。亚硫酸钙和硫酸反应又产生SO2,有关方程式为SO2+Ca(OH)2=CaSO3+H2O、CaSO3+H2SO4=CaSO4+SO2+H2O。
(5)考查根据方程式的有关计算,反应的方程式为
2SO2+O2
 2SO3 △V
2SO3 △V2 1 2 1
6.6 3.3 6.6 100-96.7=3.3
所以反应后混合气体中N2和SO3的体积比为82︰6.6
SO2的转化率是6.6÷7×100%=94.3%。

练习册系列答案
相关题目



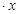 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2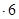 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图: 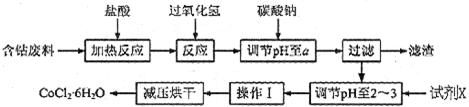
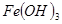
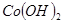
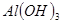
 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:

 2MgCl2+Ti在Ar气氛中进行的理由是__________________
2MgCl2+Ti在Ar气氛中进行的理由是__________________