题目内容
纯碱和硫酸都是重要的化工原料,用途非常广泛。
(1)利用氨碱法得到的碳酸氢钠经煅烧生成纯碱。工艺流程如下图所示:

氨碱法示意图
图中的中间产物C是_________,D是________(写化学式);装置乙中发生反应的化学方程式为_________________________________。
(2)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。甲企业用接触法生产硫酸采用的主要原料是硫磺和空气。工艺流程如下图所示:

为了充分利用反应放出的热量,接触室中应安装____________(填设备名称)。吸收塔中填充许多瓷管,其作用是____________。为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2的转化率,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为____________。
(1)利用氨碱法得到的碳酸氢钠经煅烧生成纯碱。工艺流程如下图所示:

氨碱法示意图
图中的中间产物C是_________,D是________(写化学式);装置乙中发生反应的化学方程式为_________________________________。
(2)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。甲企业用接触法生产硫酸采用的主要原料是硫磺和空气。工艺流程如下图所示:

为了充分利用反应放出的热量,接触室中应安装____________(填设备名称)。吸收塔中填充许多瓷管,其作用是____________。为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2的转化率,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为____________。
(8分)
(1)Ca(OH)2(1分);NH3(1分);
NH3+CO2+H2O+NaCl= NaHCO3↓+ NH4Cl(2分)
(2)热交换器(1分);增加SO3与浓硫酸的接触面积,有利于SO3的吸收(1分);
6:5(2分)
(1)Ca(OH)2(1分);NH3(1分);
NH3+CO2+H2O+NaCl= NaHCO3↓+ NH4Cl(2分)
(2)热交换器(1分);增加SO3与浓硫酸的接触面积,有利于SO3的吸收(1分);
6:5(2分)
试题分析:
(1)结合题中信息可以得出C为石灰窑的产物CaO与H2O的生成物Ca(OH)2;D为Ca(OH)2和NH4Cl反应的产物NH3;装置乙中发生的为侯氏制碱法主要反应反应NH3+CO2+H2O+NaCl= NaHCO3↓+ NH4Cl。
(2)为了充分利用反应放出的热量,接触室中应安装热交换器;填充许多瓷管,其作用是增加SO3与浓硫酸的接触面积;设有1molS反应,根据方程式S+O2=SO2,需要1molO2,生成1molSO2,为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,需要1.5molO2, 1molSO2在接触室中SO2完全氧化时理论需氧量为0.5mol,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍即1.25mol。生产过程中流经流量计1和流量计2的空气体积比应为1.5mol: 1.25mol=6:5

练习册系列答案
相关题目


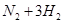


 。
。





