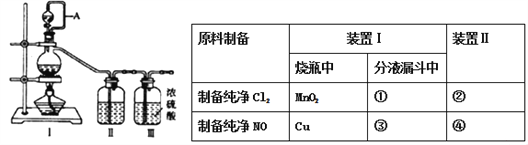
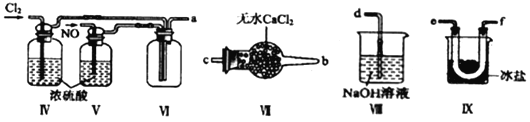
题目内容
【题目】工业上可用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:

已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+4CO2↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。
【答案】 FeSO4·7H2O Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ H2SiO3和Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 小于 蒸发浓缩、冷却结晶、过滤
2NaAlO2+CO2↑ H2SiO3和Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 小于 蒸发浓缩、冷却结晶、过滤
【解析】(1). 绿矾的化学式为FeSO4·7H2O,故答案为:FeSO4·7H2O;
(2). 焙烧过程中,Na2CO3和Al2O3反应生成NaAlO2和CO2,化学方程式为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3
2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(3). 由离子沉淀的pH范围可知,调节pH=7~8,是为了沉淀H2SiO3和Al(OH)3,所以固体Y的主要成分是H2SiO3和Al(OH)3,故答案为:H2SiO3和Al(OH)3;
(4). 由流程图可知,在酸化过程中用醋酸调节pH=5的目的是将CrO42-转化为Cr2O72-,若pH调节的过低,NO2-可被Cr2O72-氧化为NO3-,离子方程式为:Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O,故答案为:将CrO42-转化为Cr2O72-;Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O;
(5). 调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明在该条件下K2Cr2O7的溶解度最小,故答案为:小于;
(6). 所得滤液为硫酸亚铁溶液,从滤液中得到绿矾晶体的方法为:蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩、冷却结晶、过滤。

【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2