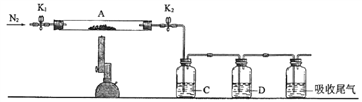
题目内容
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂_______。
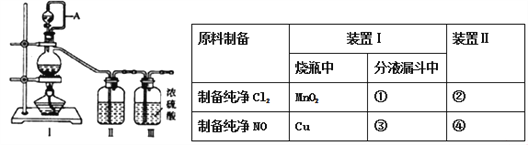
【合成亚硝酰氯】利用制得的NO和Cl2制备NOCl,装置如图所示:
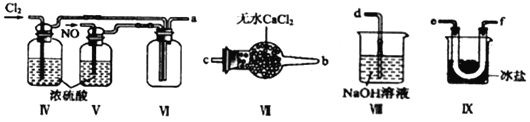
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅶ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
【答案】 ①浓盐酸 ②饱和食盐水 ③稀硝酸 ④水 通过观察气泡调节气体的流速 e→f→c→b→d(或f→e→c→b→d) 防止水蒸气进入反应器 U型管内充满黄色气体,并有红色液体凝结 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室用二氧化锰和浓盐酸加热反应制备氯气,分液漏斗中加入①浓盐酸,生成的氯气中含有氯化氢、水蒸气,因此混合气体进入到装有饱和食盐水的装置II中,以除去氯化氢,因此②中加入饱和食盐水;实验室用铜和稀硝酸反应制备一氧化氮,分液漏斗中加入③稀硝酸;由于装置内有空气,会有一部分一氧化氮氧化为二氧化氮,因此混合气体进入盛有④水的装置II中,除去二氧化氮;正确答案:①浓盐酸;②饱和食盐水;③稀硝酸;④水。
(2)装置Ⅳ、Ⅴ装有浓硫酸,除可进一步干燥NO、Cl2外,另一个作用是通过观察气泡调节气体的流速;正确答案:通过观察气泡调节气体的流速。
(3)氯气和一氧化氮混合后在装置Ⅳ中发生反应生成NOCl,通过a进入到装置Ⅳ内,进行液化,收集NOCl,多余的尾气再用碱液吸收的同时,必须用VII装置吸收水蒸气,以防止NOCl与水发生水解,所以装置连顺序为a→.e→f→c→b→d(或f→e→c→b→d);正确答案:e→f→c→b→d(或f→e→c→b→d)。
(4)装置Ⅶ内装有无水氯化钙,其作用是防止水蒸气进入反应器;正确答案:防止水蒸气进入反应器。
(5) 已知亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解;据此可知装置Ⅸ在实验时,预期观察到的现象:U型管内充满黄色气体,并有红色液体凝结 ;正确答案:U型管内充满黄色气体,并有红色液体凝结。
(6) 装置Ⅷ中装有碱液,吸收尾气时,氢氧化钠溶液与NOCl发生反应生成氯化钠和亚硝酸钠,化学方程式为:NOCl+2NaOH=NaCl+NaNO2+H2O;正确答案:NOCl+2NaOH=NaCl+NaNO2+H2O。
(7)配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应为氧化还原反应,化学方程式为HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O;正确答案:HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O。

【题目】工业上可用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
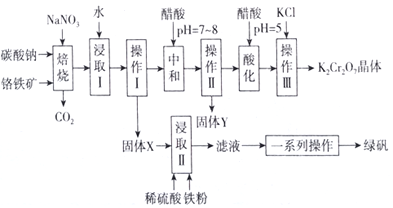
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+4CO2↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。